
Александр Никонов
Физика на пальцах. Для детей и родителей, которые хотят объяснять детям
© Александр Никонов, текст
© Сергей Корсун, иллюстрации
© ООО «Издательство АСТ»
От доброго автора
У моего знакомого есть сын лет шести. И вот однажды папа, пребывая в благостном расположении духа, ему и говорит: «Ну, сынок, спроси меня что-нибудь, а я тебе отвечу!»
– Я-то по наивности думал, – рассказывал мне потом огорченный папа, – что он спросит меня, отчего ветер дует или еще какую-то ерунду, и я ему триумфально отвечу. Но он задал три вопроса: «Откуда взялся мир? Откуда взялась наша планета? Откуда взялись на ней люди?» И я понял, что моих знаний просто не хватит для ответа ни на один из этих вопросов.
Так вот, чтобы папы не подрывались, как на минах, на таких вопросах, а дети не ввергали своих родителей в подобный конфуз, я и решил написать серию книг, популярно отвечающих на подобные вопросы. Книга, которую вы держите в руках, – о физике.
Самая главная наука – это физика, друзья мои!
На физике, как на фундаменте, стоят все прочие науки, образуя своеобразную пирамидку наук – химия, биология, психология и пр. Потому что физика изучает основу основ – материю, из которой все в этом мире сделано.
А как называется ось этой пирамидки, на которую насаживаются разноцветные кругляшки наук?
Хороший вопрос! Ось пирамидки называется эволюцией.
И блинчики наук на эту ось нанизываются по степени усложнения вещества, которое они изучают, по мере продвижения от мертвой материи к мозгу и разуму. Внизу – физика. Выше – химия. Потом – органическая химия. Затем – биохимия. Потом биология. И заканчивается все науками, изучающими высшую нервную деятельность – нейрофизиология, психология… Но в базе всего лежит физика, так как все сделано из материи, а физика изучает именно ее. Потому я и назвал физику самой главной наукой.
При этом и самая страшная наука – тоже физика! Физику многие боятся, как огня, считая трудной. Однако понимание зависит от способа изложения. Я очень жалею, что в моем детстве не было такой книжки, как эта: если бы я ее прочитал, ходил бы в школу с радостью и интересом, а не отбывать 10-летний срок.
Думаю, мою книгу будут читать не столько взрослые, сколько дети, поэтому по мере изложения я буду обращаться именно к ним, так как дети важнее взрослых. Но эту книгу втайне рекомендуется прочесть и взрослым, чтобы не попасть впросак и не спасовать при неудобных вопросах резко поумневшего ребенка.
Моя книга поможет детям не бояться физики и лучше успевать по этому предмету, а взрослым вернет в голову то, что туда недоложили в детстве из-за активного сопротивления. Кроме того, взрослым эта книга позволит по-иному взглянуть на мир. Впрочем, этой свойство всех моих книг.
Поехали?..
Часть I. Из чего же, из чего же, из чего же…
Что такое свет? Почему не всякая радиация вредна? Почему небо синее, а закат красный? Из чего сделана молния и что такое огонь? Почему далекие предметы кажутся нам маленькими, а при сближении словно вырастают в размерах? Отчего светят звезды? Что такое время? Чем порядок отличается от беспорядка? Из чего сделано тепло? Почему, если предоставить какую-нибудь вещь самой себе, она когда-нибудь в конце концов разрушится? Что такое тепловая смерть?.. На все эти вопросы отвечает физика.
Обычно изучать физику начинают с механики. Видимо, потому, что так исторически сложилось, ведь человека окружает мир твердых тел, с них он и начал путь познания, набивая по дороге знаний шишки о те самые твердые предметы.
Но мы с вами начнем с элементарных частиц. То есть с азов – с тех мельчайших частичек вещества, из которого это вещество и складывается. Если вы не против, конечно…
Глава 1. Откуда взялись атомы и зачем они нужны?
Атомы придумали древние греки. Так уж вышло, никто не виноват.
Впервые мысль о том, будто все вещество состоит из мельчайших неделимых частичек, выдвинули именно жители Древней Греции. И я вам по секрету скажу, большого ума для рождения этой идеи не требовалось! Древняя Греция – детство человечества. А любой ребенок в состоянии задуматься:
что будет, если я начну вещество делить все дальше и дальше?
Ну, например, кусочек сахара или мела? Неужели этот процесс будет происходить до бесконечности? Если до бесконечности, то есть до беспредельно ничтожных размеров, то фактически получается, что все вещество состоит из пустоты? Или все-таки когда-то я доберусь до самого маленького неделимого элемента вещества?
Но что значит неделимого? А если по нему ударить хорошенечко? Может, он и разделится, но уже не будет обладать свойствами указанного вещества – вот что имеется в виду.
Кстати, а что такое свойства? И какие они бывают?
Веществ разных в мире много. Есть камень, стекло, вода, железо, дерево, пластмасса… И у всех веществ разные свойства – твердость, цвет, плотность, хрупкость, способность проводить электрический ток, нагреваться и так далее.
Дерево плавает, а железо тонет. Дерево горит, а железо нет. Железо проводит электричество, а дерево нет. У железа высокая теплопроводность, попробуйте сунуть гвоздь в огонь – через очень короткое время он нагреется так, что его станет невозможно держать в руке. А вот горящую деревянную палочку (например, спичку) можно держать в руках долго – до тех пор, пока огонь не доберется до пальцев. Потому что у дерева теплопроводность очень низкая, очень плохо оно проводит тепло. А железо и все прочие металлы – отлично!
А кроме теплопроводности есть еще такое свойство, как теплоемкость. Это способность вещества накапливать тепло. Возьмите тонну воду и тонну золота и нагрейте градусов до 50 °C. Вода потом будет еще долго-долго оставаться теплой, а золото очень быстро остынет. Не запасает оно тепло. Низкая у золота тепловая емкость.
Зато золото гораздо плотнее воды! Представьте два одинаковых по размеру кубика из золота и воды… Не знаете, как сделать кубик из воды? Ну спросите папу, он поможет – разольет воду в специальную форму, похожую на вафлю, сунет в морозилку, потом вытащит замороженную воду в виде кубиков, один кубик отдаст вам, погладив по голове, а остальные бросит себе в бокал с алкоголем. После того, как папа станет добрый, попросите у него еще такой же по размеру кубик золота. И когда папа достанет его из кармана, возьмите два полученных кубика и быстро бегите взвешивать, пока ледяной кубик совсем не растаял.
Результат взвешивания покажет, что золотой кубик примерно в 20 раз тяжелее ледяного. 20 ледяных кубиков уравновесили бы на весах один золотой. Потому что золото плотнее. Физики говорят так: у золота выше плотность. Плотность – это количество вещества в одном объеме – например, в одном стакане, кубическом сантиметре или одном кубическом метре. Один кубический метр воды весит одну тонну, а кубометр золота чуть ли не 20 тонн. Не всякий поднимет!
И раз уж пошла такая пьянка (у папы), я вам больше скажу, друзья мои! Зря мы соблазнили папу и замораживали воду, переводя ее в твердое состояние. Потому что плотность твердой воды (льда) отличается от плотности жидкой воды. Плотность льда чуть меньше, чем плотность воды, поэтому твердая вода в жидкой воде плавает словно дерево – вы сами сто раз видели, как лед плывет по реке. Дерево плавает в воде по той же причине – его плотность меньше плотности воды.
Кстати, вот еще одно характерное свойство вещества – температура замерзания.
Как известно любому мальчику, дяденьке и пенсионеру, одно и то же вещество – вода, например, – может находиться в разных состояниях. Вода может быть жидкой. Такой она бывает, когда тепло. Вода может быть твердой, когда холодно. И она может быть газообразной или, попросту говоря, газом. Газообразная вода называется паром. Если воду налить в кастрюлю и начать нагревать, в конце концов она вся выкипит. То есть превратится в водяной пар. Ну и черт с ней!
Не жалко, еще из крана нальем.
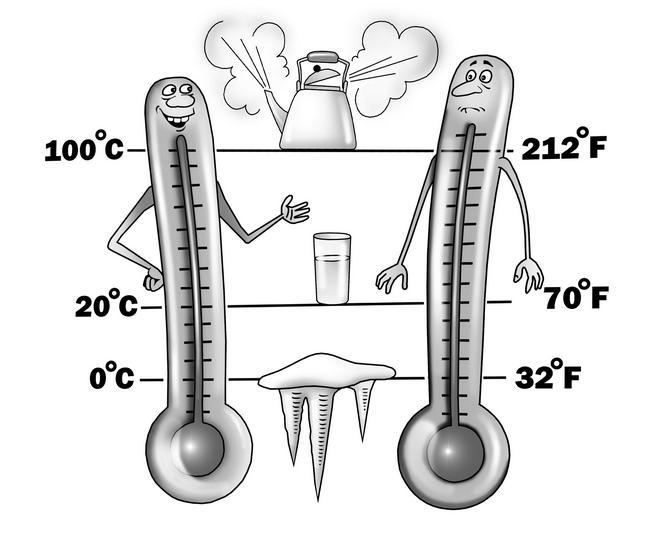
У каждого вещества своя температура замерзания (она же температура плавления). Температура замерзания/плавления воды – ноль градусов по Цельсию. Температура кипения – 100 градусов. Как же так удивительно получилось? Что за чудесное совпадение? Почему так ровно – ноль и сто? Эта вода нарочно что ли так себя ведет для нашего удобства? Неужели сама природа об этом позаботилась?
Нет, конечно. Просто тот мужик по имени Цельсий, который придумал градусную шкалу, нарочно принял за ноль градусов температуру замерзания, а за сотню – температуру кипения воды. Оттого нам теперь и удобно. А вот другой дядька по имени Фаренгейт придумал другую температурную шкалу, крайне неудобную – по Фаренгейту вода замерзает при +32°, а кипит при +212°. Это отвратительно! Шкалой Фаренгейта теперь пользуются в Америке. Все у них не как у людей…
Но как же он так опростоволосился, этот Фаренгейт?
Я вам отвечу. Вместо воды он замораживал смесь воды, нашатыря и соли. А за сто градусов принял… думаете, температуру кипения этой смеси? Нет! Температуру человеческого тела. Причем, что интересно, в качестве тела он использовал собственную жену. У которой в то время температура была повышенная, поскольку она болела. Очень непростой был парень этот Фаренгейт!
Вообще температурных шкал довольно много, и все они названы в честь физиков, которые их придумали – шкала Реомюра, шкала Кельвина, шкала Делиля, шкала Ранкина… Но мы с вами в быту пользуемся только шкалой Цельсия. Она очень удобна. Летом температура имени Цельсия плюсовая, зимой минусовая, все прекрасно и привычно. На улице минус двадцать? Мороз! Плюс тридцать? Жара!.. А под мышкой? У здорового человека 36,6 градуса. Выше – заболел. Ниже – помер.
В общем, самых разных свойств у разных веществ целое море. Веществ же на свете еще больше. И каждое вещество характеризуется своим набором свойств.
Два термометра – Цельсия и Фаренгейта. Какой вам больше нравится?
Одинаковые кубики разных веществ весят по-разному.

Теперь дальше следите за мыслью древних греков – как они додумались до атомов.
Килограмм одного и того же вещества имеет такие же свойства, как и и полкило, что понятно: и большое оконное стекло пропускает свет, и маленькое обладает свойством прозрачности. И короткий кусок медного провода пропускает электрический ток, и длинный электропроводен. И маленький кусок дерева плавает в воде, и большой. От размеров свойства не зависят.
Но действительно ли не зависят?
Есть ли предельный по малости кусочек вещества, который еще обладает свойствами этого вещества, а после дробления – уже не обладает, и мы получим нечто другое?
Есть, решили греки и назвали его атомом! Мне кажется, к этому соображению их привели следующие рассуждения.
Вот смотрите… Из двух разных веществ можно сделать третье – с совершенно другими свойствами, которыми не обладают первые два. Ну, например, можно в расплавленную медь добавить другой металл – олово. И получится сплав под названием бронза, который обладает особой твердостью, которой ни медь, ни олово по отдельности не обладают. Бронза тверже меди и тверже олова. Значит, если мы будем долго делить бронзу на части, в конце концов останется самая малая частичка бронзы, которая уже при делении распадется на медь и олово. И бронзы уже не будет.
Логично?
Но отсюда один шаг до следующей идеи – а может, все вещества в мире тоже состоят из более простых элементов? И быть может, элементов этих не так уж много? Как из цветной мозаики или нескольких красок можно сделать бесконечное множество картин, как из малого числа букв можно сделать сотни тысяч слов и миллионы разных книг, так и из ограниченного числа этих элементов складывается бесконечно множество веществ?
Богатая идея.
Древняя Греция – это, как я уже сказал, детство человечества. Никаких наук в нашем понимании этого слова тогда еще не было. Греки практически ничего не знали о строении вещества, но зато много фантазировали, пытаясь силой мысли проникнуть в самую суть вещей. И додумались до следующей картины мира…
Они решили, что все огромное разнообразие самых разных веществ в мире на самом деле состоит их четырех простых элементов – земли, воды, огня и воздуха. Милые смешные греки! Они, конечно, ошибались, но их ошибка была гениальной. Греки сделали большой шаг вперед – отказались от мифологических, религиозных объяснений и применили к познанию мира научный принцип анализа, начали говорить о взаимопревращении веществ. Направление их мысли оказалось верным, и в дальнейшем наука подтвердила: действительно все многообразие мира складывается из простейших составляющих. Эти «простейшие вещества» так и назвали «элементарными» или просто «химическими элементами».
Сколько же существует элементарных веществ?
Не буду вас томить, отвечу сразу – около сотни. Не так уж мало. Многие из них вы знаете. Золото, например. Железо. Свинец. Вообще, все известные металлы – это химические элементы, то есть простейшие вещества.
И многие газы.
А сталь? Сталь – это сплав двух элементов – железа и углерода. В чистом виде железо нигде не используется, поскольку оно мягкое. Углерод же вы прекрасно себе представляете, он является основой угля (поэтому так и называется – «углерод», то есть «рождающий уголь»). Соединение железа и углерода дает нам сталь или чугун (в зависимости от количества добавленного в железо углерода, если мало углерода – сталь, много – чугун).
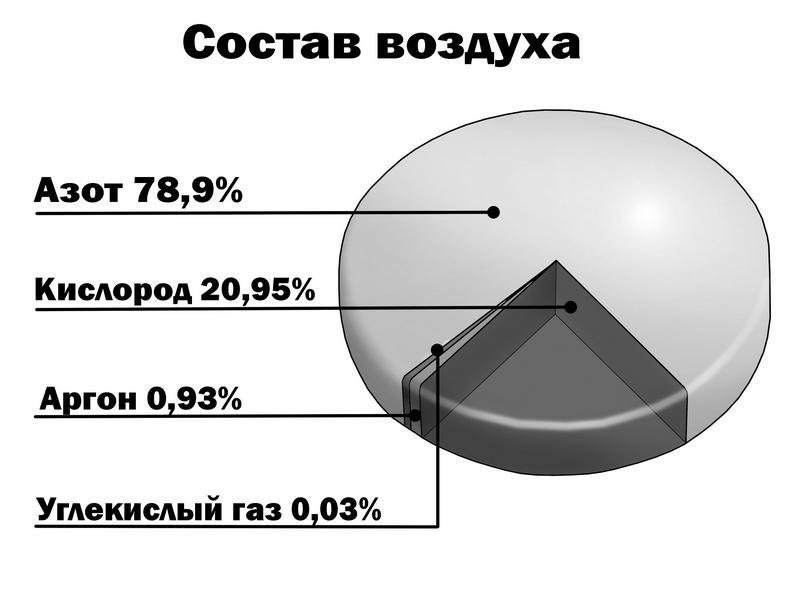
А воздух? Воздух, которым мы дышим, тоже «сплав», точнее, смесь разных газов, среди которых кислород, азот и углекислый газ.
Кислород и азот – химические элементы, то есть простейшие вещества. А вот углекислый газ – сложное вещество, состоящее из двух простых элементов – кислорода и углерода. Одна частица углекислого газа состоит из одной частицы углерода и двух частиц кислорода. На рисунке это прекрасно видно.
Химики записывают углекислый газ короткой формулой – СО2.
Понять формулу немудрено: один атом углерода (С) и два атома кислорода (О).

А вода – составное вещество или элементарное?
Вода вещество составное. Она сделана из двух элементарных газов – водорода и кислорода: одна частица воды состоит из двух частиц водорода и одной частицы кислорода. Самая маленькая частица воды называется молéкулой. И не только воды, кстати. Самая маленькая частица любого сложного вещества называется молéкулой. А самая маленькая частичка элементарного вещества называется атомом. Молекулы строятся из атомов.
Так, молекула воды сделана из двух атомов водорода и одного атома кислорода. А водород так назвали именно потому, что он рождает воду.
Молекула воды – Н2О, то есть два водорода (Н) и один кислород (О).
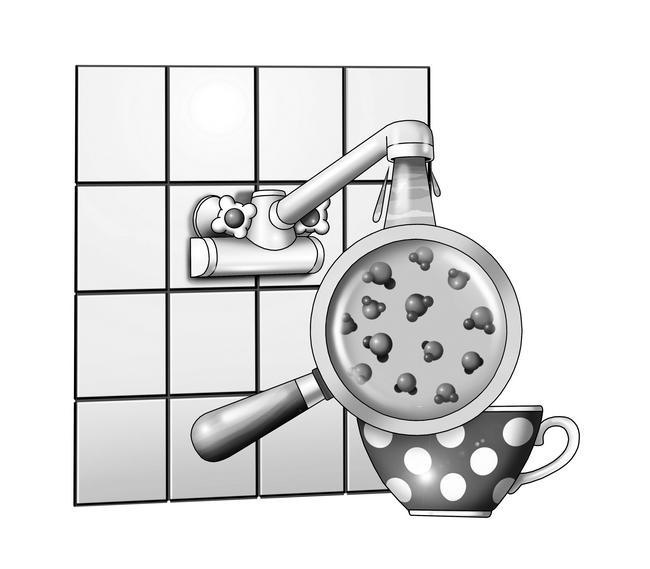
Воду можно дробить на капельки не бесконечно – в конце концов у нас останется самая маленькая частица воды – молекула. И если разделить молекулу воды, она развалится на кислород и водород. То есть на атомы.
Еще раз: молекулы сделаны из атомов. Атомы – простейшие, неделимые, элементарные вещества, а молекулы – вещества сложные, составные.
Что же у нас получается?
Получается, что атомы – это детальки конструктора, из которых собираются разные вещества. Деталек довольно много, около сотни, но все же ограниченное количество. Однако из них можно собрать тысячи, миллионы разных конструкций!
Самые сложные молекулы содержатся в нашем теле. Они могут состоять из миллионов атомов!
А как определить, что перед нами – элементарное вещество или сложное? Понятно, что если речь идет о живом веществе, то оно не просто сложное, а очень навороченное! А если нет? Вода, золото, соль, серебро, свитер, резина, майонез, бумага – как узнать, это составные вещества или элементарные?
Да очень просто! Взять и посмотреть в специальную табличку. Там все детали мирового «конструктора» прописаны. Это очень знаменитая табличка! Ее составил один умный русский дядя по фамилии Менделеев. С тех пор она так и называется – таблица Менделеева.
Дмитрий Иванович Менделеев очень любил заниматься химией. Помимо химии, у Иваныча было еще одно увлечение, – старик очень любил делать чемоданы.
Я вообще рекомендую вам, если вы родитель, купить ребенку, наряду с географической картой мира, столь же большую таблицу Менделеева и повесить в детской комнате.
А если вы ребенок, строго возьмите папу-маму за палец, отведите в ближайшую субботу в большой книжный магазин и потребуйте незамедлительного приобретения таблицы Менделеева с последующим размещением ее на вашей любимой стенке – рядом с картой мира. Периодически к таблице нужно подходить, вдумчиво смотреть на нее, выискивать какой-нибудь элемент и читать про него в приложении к этой книге, в самом конце. А потом рассказывать маме, поражая ее невероятным умищем. После чего как бы невзначай просить немного денег на карманные нужды. Знания должны приносить доход!
Таблица химических элементов Менделеева.
Знаете, что вам нужно сделать? Заложите закладку на странице с этой табличкой, потому что мы будем периодически к ней возвращаться и каждый раз удивляться чему-то. Вам должно быть удобно искать страницу с табличкой. Можно сделать так: одна закладка обычная, которой вы закладываете текущую страницу, чтобы потом быстрее ее открыть – пусть она будет направлена вверх. А вторая закладка, на странице, где табличка Менделеева, пусть торчит вниз. Очень по-умному получится.

И еще… Никого не должен смущать тот факт, что в этой книге про физику мы некоторое количество букв и времени уделим химии. Потому что химию можно с полным правом назвать одним из разделов физики – вот так!
Ну, а пока на стенке большой таблицы у вас нет, посмотрите на нее здесь. Таблица красивая, как мозаика. Это химическая палитра. Это краски, которыми нарисован мир. На цифры и буквенные обозначения элементов пока никакого внимания не обращайте, просто почитайте для интереса названия химических элементов, их которых сделан весь наш мир – миллионы разных веществ, звезды, планеты, мы. Поищите знакомые. Найдите золото. Найдите свинец, серебро, железо. Поищите кислород, который необходим нам для дыхания.
(Химические элементы в табличке для краткости обозначаются буквами латинского алфавита и являются простыми сокращениями латинских слов. Например, золото на латыни «аурум», оно так и обозначается – Au от латинского aurum. Свинец по-латински «плюмбум» – Pb. Серебро – Ag от латинского «аргентум».
И так далее. Запоминать ни в коем случае не надо! Оно само потом запомнится так, что не отлепишь.)
Теперь, если вам нужно определить, какое вещество папа налил в рюмку – сложное или элементарное, – достаточно поискать его в таблице. Например, папа налил в рюмку кефир. Ищем в таблице Менделеева кефир. Есть он там, среди простейших веществ? Нету тут никакого кефира! Значит, кефир – сложное вещество, сконструированное из простейших элементов, которых всего около сотни, и все они у нас теперь как на ладони. Спасибо старику Менделееву!
Сразу скажу – чего бы вы ни хватились, в таблице Менделеева вы, как правило, этого не найдете.
Нет там воды, стекла, мела, пластмассы, дерева, кожи, селедки и прочих тысяч веществ и существ. Вывод? Он прост: нас окружают сложные вещества – их кругом миллионы! А вот простые вещества из таблицы Менделеева вокруг себя еще поискать нужно – какую-нибудь алюминиевую ложку или отрезок медной проволоки, кусочек свинца, мамино золотое колечко, воздушный шарик, внутри которого накачан газ гелий (найдите перечисленное в таблице)…
В общем, принцип понятен: из атомов простейших веществ (химических элементов), которые дедушка Менделеев смел своей бородой в табличку, собираются молекулы сложных веществ. Вода, как мы уже знаем, собрана из двух атомов водорода и одного атома кислорода. Ну а, например, соль? Та самая белая поваренная соль, которая хранится у вас дома в солонке?
Это сложное вещество. Молекула соли состоит из одного атома металла по имени натрий и одного атома газа по имени хлор. Нашли их в таблице?
Натрий – очень редкий и мягкий металл, его можно ножом резать. Если кусок натрия бросить в воду, то лучше сразу убежать подальше. Потому что натрий зашипит, начнет бегать по поверхности воды, выделяя белый дым, затем вспыхнет и загорится ярким пламенем, а потом и вовсе взорвется, если кусок достаточно велик. Очень активный металл!
А хлор – это очень ядовитый газ. Этот газ во время Первой мировой войны применяли для удушения противника – дожидались, когда ветер подует в сторону врага и открывали вентили баллонов. Газ несло ветром на вражеские окопы и надышавшиеся солдаты гибли. (Подробнее об этом вы можете почитать чуть дальше, в специальном разделе, посвященном газам.)
Но каков фокус! Из двух таких крайне агрессивных веществ, как натрий и хлор, получается вполне безобидная и даже полезная соль. Металл – блестящий, взрывающийся, он проводит электрический ток. Газ – ядовитый, зеленоватый и летучий. А соль? Вы ее прекрасно видели – белая, неопасная, не летучая и не ядовитая, ее можно есть. И никакого электрического тока она не проводит. Совершенно другие свойства!
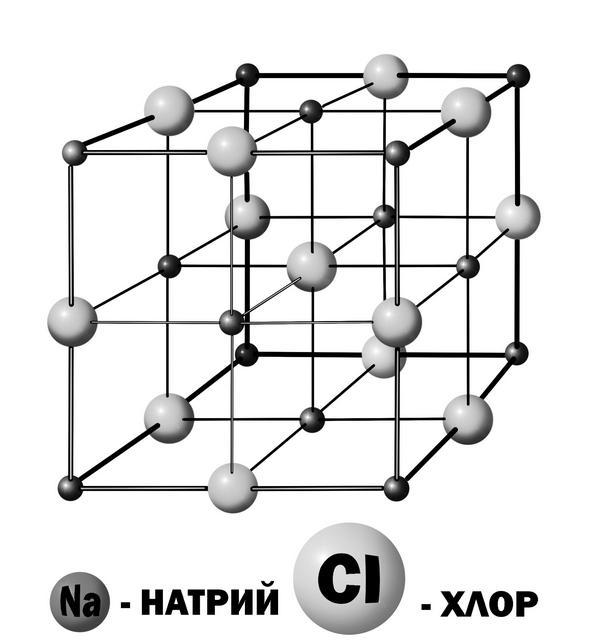
По-научному поваренная соль называется хлоридом натрия и записывается химиками так – NaCl (натрий хлор).
Как устроен кристаллик хлорида натрия? Вот он, на рисунке, посмотрите. Белые шарики – это атомы хлора, а серые – атомы натрия.
Кто-то может спросить:
– А почему белые шарики больше серых? Неужели атомы газа хлора больше, чем атомы металла натрия?
Именно так!
Кристаллик поваренной соли
Посмотрите в волшебную таблицу старичка на букву М. – чем ниже и правее атом, тем он больше по размеру и тяжелее. Чем он левее и выше – тем легче. Почему это так, мы поймем немного позже, когда вы с помощью этой книги познаете, как устроен мир до таких глубин, коих не знает в вашем возрасте никто.
Дошкольники и школьники младших классов не знают, потому, что им не попалась такая чудесная книга, как эта.
Взрослые – потому, что все уже давно забыли.
А школьники старших классов – потому, что дурака валяют на уроках вместо того, чтобы учиться.
Один вы умный и хороший.
Теперь, умный и хороший, еще раз гляньте на картинку соляного кристаллика. То, что вы видите, называется кристаллической решеткой. Вот этот кубик, эта вот жесткая пространственная структура, в которой атомы находятся каждый на своем месте и неподвижно стоят там, как солдаты в строю, носит гордое звание кристаллической решетки. Именно жесткостью этой решетки и объясняется твердость вещества.
Кристаллическую решетку называют решеткой, потому что она похожа на решетку. Вот так вот все сложно в этой физике!
Молекулы воды, когда она превращается в лед, выстраиваются именно в форме такой вот жесткой решетки. Поэтому лед твердый.
А когда вода жидкая, как расположены молекулы?..
А когда вода жидкая, ее молекулы расположены в хаотическом беспорядке, они суетятся, толкаются друг с другом, меняются местами – в общем, ведут себя, как толпа в метро. Они все еще тяготеют друг к другу, но уже очень подвижны от накачанного тепла, поэтому вода жидкая. Ткнул в нее пальцем и легко раздвинул молекулы. А в льдышку с ее жесткой кристаллической решеткой сколько пальцем ни тыкай, толку будет мало, если не считать сломанного пальца.
А если вода превращается в газ и вылетает из носика чайника в атмосферу, что происходит тогда?..
А вот тогда она полностью теряет всякую структуру.
У любого газа, включая водяной пар, молекулы уже не притягиваются друг к другу, а стремятся разбегаться во все стороны. Расстояние между ними становятся во много-много раз больше, чем в жидкости, поэтому газ такой неплотный и летучий. Его молекулы можно сдержать вместе только в какой-нибудь оболочке, типа баллона или воздушного шара. Но стоит в оболочке образоваться дырке, как молекулы начинают оттуда разлетаться.

То, что чуть выше написано касательно жидкости, было прекрасно продемонстрировано еще в XIX веке английским ученым по фамилии Броун. Интересно, что Броун не был физиком, а был безобидным ботаником, изучал растения и свое открытие в физике сделал случайно.
Броун изучал под микроскопом пыльцу растений и заметил, что маленькие частички пыльцы, находящиеся в воде, все время дрожат и немного двигаются то в одну сторону, то в другую. В общем, они хаотически, то есть беспорядочно, перемещаются, словно живые. Позже выяснилось, что так же ведет себя не только пыльца растений, но и любое вещество, растертое в мельчайшую пыль.
Оказалось, хаотичное движение пылинок, их дерганье туда-сюда вызывается беспорядочным движением молекул воды, которые барабанят в пылинку.
Конечно, даже самые микроскопические пылинки любого вещества – настоящие гиганты по сравнению с молекулами воды! Молекула по сравнению с пылинкой – все равно, что кошка по сравнению с небоскребом. Кошка не может сдвинуть небоскреб. Пылинка состоит из миллионов и даже миллиардов молекул. Но ведь и вокруг пылинки тоже беспорядочно мечутся миллионы и миллиарды молекул воды! И когда в какой-то момент с одной стороны пылинку случайно толкает чуть больше молекул, чем с другой стороны, она чуть смещается в ту сторону. Потом в другую. Так и ползает туда-сюда, беспорядочно дергаясь каждую секунду туда, куда ее стукануло больше молекул.
В честь первооткрывателя этого явления ботаника Броуна подобное бессмысленное движение частичек в воде называют броуновским движением. Оно и вправду совершенно бестолковое, случайное.
Теперь вот какой вопрос. Понятно, что все молекулы любого вещества имеют свойство притягиваться друг к другу. Иначе вещество просто разваливалось бы на молекулы. А так все вокруг прекрасно существует и не разваливается. Стоит шкаф и не рассыпается на молекулы. И книжка перед вами даже не думает разлетаться в пыль.
Почему же тогда у молекул газа это свойство притяжения теряется? Если воду превратить в газ, она разлетится во все стороны…
Все дело в том, что у газа процесс притяжения молекул полностью пересиливается другим процессом. Каким? Отталкиванием, что ли? Но разве могут частички вещества одновременно обладать свойством и притяжения, и отталкивания друг к другу?
Разгадка в том, что в твердом веществе молекулы вещества почти неподвижны. Они находятся в узлах кристаллической решетки, сцепившись, и только чуть-чуть трясутся. Оттого твердое вещество такое прочное. В жидкости же скорость молекул больше, и они уже не удерживаются в плотной застройке структурной решетки, а топчутся бесформенной толпой. А вот в газе скорость молекул еще больше.
Она такая большая, что молекулы просто проскакивают друг мимо друга, поскольку мечутся с огромными скоростями.
Эти скорости молекулам сообщает нагрев. Нагрели лед – он растаял. Нагрели воду – закипела, превратилась в пар. Но что такое нагрев и что такое тепло?
К этому вопросу мы еще вернемся, а пока вот вам наилучшая аналогия твердого, жидкого и газообразного.
Дети в классе – это кристалл. Они сидят за партами по своим ячейкам решетки, образованной рядами парт.
Дети на уроке физкультуры – жидкость. Они бегают по всему залу, прыгают, но из зала не выходят, а держатся все вместе, одним классом.
А вот хаотичные дети на переменке – это сущий газ! Класс распадается, и ужасные дети, приобретя энергию безумия, начинают носиться по всей школе, сталкиваясь друг с другом в броуновском движении и норовя сбить с ног толстые пылинки случайных взрослых посетителей или учителей. Так они и будут носиться, пока их не заморозит школьный звонок.
ГАЗЫ!
Кислород O2
Самый важный для человека газ. И не только для человека. Все живое на Земле дышит кислородом. Без кислорода человек может существовать всего несколько десятков секунд. Раньше была такая казнь – через удушение: человеку затягивали горло веревкой, перекрывая доступ кислорода в легкие, и организм переставал функционировать.
Атомы кислорода держатся парами, образуя одну молекулу кислорода, поэтому сей газ обычно записывают с маленькой двоечкой внизу (см. выше). Кстати, то же самое касается и многих других простейших газов.
Земная атмосфера на 21% состоит из кислорода, что весьма недурственно.
В нашем организме кислород участвует в процессе окисления разных веществ. Окисление – научное название горения. Дрова в костре окисляются, то есть горят, и мы видим результат этой бурной реакции в виде пламени. При этом выделяется много тепла и света. Можно сказать, что горение происходит и внутри человека, только без огня, потому что оно очень медленное и неспешное. А топливом для внутреннего костра является проглоченная нами пища. Кстати говоря тот факт, что человек теплый – результат внутреннего медленного горения, то есть реакции окисления.
Водород H2
Самый легкий газ на свете. Поэтому раньше, до эпохи самолетов, им наполняли дирижабли. И точно так же, как легкие деревяшки всплывают из-за того, что дерево легче воды (точнее было бы сказать, что дерево менее плотное, чем вода) – так и дирижабль, наполненный легким газом, всплывает в более плотной атмосфере. Он ведет себя, как деревяшка в воде.
Дирижабли, наполненные водородом, сто лет назад перевозили пассажиров, совершая трансатлантические рейсы из Европы в Америку. Но поскольку водород очень горючий газ, порой из-за случайно искры случались ужасные катастрофы.
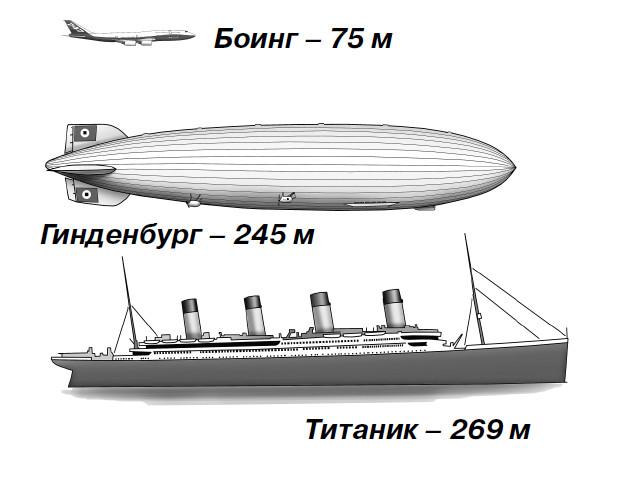
Наиболее известная из них – катастрофа, случившаяся с «Гинденбургом». Это был самый большой воздушный корабль в мире. Размером он был практически, как «Титаник» – самый большой в мире на тот момент пассажирский корабль. И обоих гигантов постигла печальная участь:
«Титаник» утонул, столкнувшись с айсбергом, а «Гинденбург» сгорел, встретившись со случайной искрой. Случилось это так…
Вечером 6 мая 1937 года «Гинденбург», перелетевший Атлантический океан, на малом ходу подруливал к посадочной мачте в Нью-Йорке. Его пассажиры любовались городом, а внизу горожане глазели на летящую махину дирижабля. И посмотреть было на что!
Воздушный гигант был оснащен четырьмя дизельными двигателями марки «Даймлер-Бенц», каждый из которых имел мощность в 1200 лошадиных сил. Дирижабль мог поднять 100 тонн полезной нагрузки (то есть не считая пассажирского салона, разного оборудования, моторов и дизельного топлива, коего на борту было 60 тонн). С помощью пропеллеров «Гинденбург» разгонялся в безветренную погоду до 135 километров в час. Не очень большая по нынешним временам скорость, конечно. Но по сравнению с пароходами это все-таки большой прогресс, ведь скорость того же «Титаника» была всего 40 км/ч и считалась большой. Правда, «Титаник» брал на борт больше тысячи пассажиров, а «Гинденбург» всего 72.







