
Алексей Александрович Яковлев
Реабилитация при болезни Паркинсона
Диагностика болезни Паркинсона
Доклиническая диагностика
В настоящее время известно, что для БП характерна продромальная фаза, однако выявление людей с субклиническими проявлениями БП остается сложной задачей. Результаты патологоанатомических исследований свидетельствуют о том, что на момент постановки диагноза в черной субстанции отмечается выраженная потеря нейронов, а в последующие 4 года происходит почти тотальная гибель дофаминовых окончаний в дорсальной области стриатума. Путем экстраполяции этих данных было рассчитано, что патологические процессы в головном мозге начинаются за 5—10 лет до появления первых клинических симптомов и постановки диагноза, поэтому перспективным представляется поиск предикторов БП. Среди возможных предикторов БП выделяют: поведенческое расстройство фазы быстрого сна (ПРФБС), идиопатическую аносмию и моногенные мутации, тесно связанные с БП.
ПРФБС характеризуется отсутствием мышечной атонии во время фазы быстрого сна, из-за чего во сне могут возникать вокализации или сложные двигательные акты. Расстройство, как правило, манифестирует у мужчин старше 50 лет (средний возраст 50—65 лет). ПРФБС тесно связано с БП и другими синуклеинопатиями, такими, как деменция с тельцами Леви и мультисистемная атрофия, и часто впервые выявляется при этих заболеваниях у людей с отсутствием расстройств сна в анамнезе. Кроме того, почти у всех людей с ПРФБС впоследствии развивается одно из трех заболеваний. ПРФБС как изолированное расстройство и как продромальная фаза БП сочетается с объективными и субъективными признаками моторного и немоторного дефицита, включая нарушение баланса равновесия, изменение походки и другими большими и малыми признаками двигательной заторможенности.
Хроническая аносмия или гипосмия может быть обусловленной рядом состояний: врожденных, посттравматических, постинфекционных, идиопатических, или быть связанной с нейродегенерацией. Аносмия – нередкое явление, оно встречается в 20% популяции. Аносмия характерна для большинства пациентов с БП. У родственников лиц с БП, не имеющих нейропсихических или установленных обонятельных расстройств, нарушения обоняния свидетельствуют о повышенном риске развития БП в течение 2 лет. Потеря обоняния ассоциирована с 5-кратным повышением риска БП в течение 4 лет наблюдения, при поправке на возраст и другие факторы, играющие роль в развитии БП (курение сигарет, потребление кофе, запоры).
В исследовании факторов риска БП (The Parkinson At-Risk Study, PARS) проводился поиск признаков продромальной фазы заболевания. Были обследованы 669 взрослых человек старше 50 лет с гипосмией, как основным продромальным признаком БП, и 4330 человек с интактным обонянием. В группе с нарушением обоняния чаще встречались запоры (21% против 16% в группе с интактным обонянием), тревога (в психическом статусе у 19% против 14%, как черта личности у 23% против 17%) и депрессия (19% против 11%). Признаки ПРФБС также были более распространены у людей с гипосмией (12% против 7% или 3% против 1% для непроизвольных движений разной интенсивности). В другом аналогичном исследовании около 700 человек в возрасте 50—85 лет с признаками продрома (нарушение обоняния, депрессия или ПРФБС) осматривались дважды в год. Выраженные различия были отмечены в частоте возникновения запоров (7% в группе аносмии, 22% в группе ПРФБС и 25% в группе депрессии), нарушений сна, отличных от ПРФБС (34%, 65% и 53%, соответственно), зрительно-пространственного восприятия (2,2%, 12% и 14%, соответственно), ортостатической гипотензии (13%, 33% и 25%) и когнитивных нарушения (брадифрения: 24%, 36%, 46%, запоминание слов: 37%, 60%, 53%). Таким образом, наиболее тесные связи с остальными признаками были выявлены для ПРФБС.
Методы исследования обонятельного анализатора.
В Европе с 1995 года cертифицирован Sniffin’ Sticks test (Сниффин Стикс тест, ССТ). Сейчас его используют в Германии, Австрии, Швейцарии, Италии. Тест является многоразовым, портативным, функционирует 6—12 мес. Включает скрининг и экстендид (расширенный) тесты (рис. 9).

Рис. 9. Комплект для проведения Sniffin’ Sticks test.
ССТ состоит из трех испытаний:
1. Определение порога обоняния, чувствует ли пациент запахи. Порог – это та минимальная концентрация запаха, которую ощущает пациент. В 16 пронумерованных карандашах находится н-бутанол в разных концентрациях от 1 до 16 по убыванию интенсивности запаха. В триплет входит один карандаш с запахом, два без. Тест начинается с того, что испытуемому предлагают определить, чувствует ли он запах в карандаше N1 с самой высокой концентрацией н-бутанола. Затем подносят карандаш N16, 15, 14… и т. д. до правильного определения карандаша с запахом. Карандаши в триплете меняют местами и проводят повторное исследование. Результат считается положительным, когда повторное исследование совпало с предыдущим. Далее проводят то же самое с другой пробиркой с большей интенсивностью запаха и т. д. В тесте должно быть 7 максимальных ответов, по последним 4 из которых выводят среднее значение.
2. Определение дискриминации. Это способность выбрать 2 одинаковых запаха из 3 предлагаемых. Тест состоит из 16 пронумерованных триплетов, каждый карандаш в триплете дается 1 раз. Сумма положительных ответов из 16 является количественным результатом теста.
3. Определение идентификации. Способность определить запах по предложенным 4 наименованиям. Пациенту подносят по 1 карандашу из 16 для вдыхания запаха, перед глазами он имеет 4 названия запахов, один из которых должен выбрать (рис. 10). Результат складывается из суммы положительных ответов на 16 предъявленных запахов.

Рис. 10. Процедура проведения исследования обонятельного анализатора.
Smell identification test или Пенсильванский тест разработан в 1984 году в Пенсильванском университете (США). Тест Пенсильванского университета позволяет выявить большинство нарушений обоняния и исключить симуляцию расстройств обоняния. Тест содержит 40 образцов различных запахов с четырьмя вариантами ответа каждый. Образцы запаха представляют собой пластинки микрогранул, нанесенные на плотную бумагу (рис. 11). Тест снабжен точным количественным расчетом показателей, свидетельствующих о развитии заболевания. Достоинством теста являются: надежность, низкая себестоимость, простота использования, возможность тестирования в любых условиях, даже самотестирования в домашних и полевых условиях. Тест отличает очень высокая воспроизводимость результатов (r=0,90—0,92).

Рис. 11. Smell identification test или Пенсильванский тест.
Методы исследования нарушений почерка.
Современные технологии позволяют оценивать параметры почерка по объективным показателям. Специалистами из Университета Хайфы Сарой Розенблюм и профессором Тамаром Вейссом с этой целью был разработан прибор под названием «ComPET». Он состоит из беспроводной электронной ручки и бумаги, наложенной на электронную табличку, на которой человек пишет. Система состоит из двух блоков: для сбора и для анализа данных. Прибор оценивает время контакта ручки с бумагой и время, когда ручка зависает в воздухе, скорость и ускорение, размер букв и промежутки между буквами, степень давления ручки на бумагу и т. д. Специальный софт проводит графический компьютерный анализ. К его разработке были привлечены специалисты-почерковеды. Образцы почерка сохраняются в оцифрованном виде, что позволяет сравнивать их в разных группах и через разные промежутки времени. В случае БП появляется возможность следить за развитием и прогрессированием заболевания.
В эксперименте с участием 40 испытуемых прибор «ComPET» по анализу почерка выявил БП на ранней стадии с точностью 95%. Ранее с помощью этой же методики ученые из Университета Хайфы выявляли детей с синдромом гиперактивности с нарушением внимания, почерк которых имеет характерные особенности. Кроме того, такую систему можно использовать и для коррекции нарушений почерка, в этом случае она работает по принципу биологической обратной связи.
Диагностика на ранних и поздних стадиях болезни Паркинсона
Анамнез, жалобы и клинические проявления.
Диагностические критерии.
Жалобы:
· тремор (мелкое дрожание конечностей, головы) в конечностях, голове. Обычно возникает в покое, уменьшается при попытке двигать конечностями;
· скованность в мышцах – усиливается при повторных движениях (каждое движение выполняется все сложнее);
· нарушение походки (ходьба мелкими шаркающими шажками); · частые падения (возникают из-за развившейся неустойчивости пациента);
· замедленность движений;
· бедность мимики (отсутствие мимики, лицо практически не выражает эмоций);
· ухудшение памяти, мышления;
· эмоциональные нарушения: склонность к ворчливости, подавленное настроение;
· повышенное слюноотделение изо рта.
Анамнез:
· необходимо уточнить в каком возрасте началось заболевание, какие симптомы были его первым проявлением;
· необходимо уточнить, как началось заболевание (постепенно (незаметно) /внезапно, в связи с какими-либо факторами);
· обратить внимание на наличие когнитивных нарушений, депрессии, галлюцинаций;
· выяснить наличие в семейном анамнезе БП/других нейродегенеративных заболеваний (либо их отдельных симптомов, например, тремора) у родственников, наличие в анамнезе повторных травм головы, профессионального/бытового контакта с токсичными веществами;
· в отношении принимаемых в настоящее время лекарственных средств, уточнить наличие сопутствующих заболеваний.
Физикальное обследование.
Неврологический статус:
· гипокинезия (акинезия);
· ригидность;
· тремор в покое, представляющий ритмическое дрожание II, III и противопоставленного им I пальца кисти с частотой 4—6 Гц, напоминающий скатывание пальцами хлебного шарика (по типу «катания пилюль»/«счёта монет»). В начале заболевания тремор односторонний/асимметричный, усиливается на холоде, при эмоциональном напряжении и усталости, ходьбе, движениях в контралатеральной руке. При движении конечности тремор уменьшается/исчезает, во время сна отсутствует. По мере прогрессирования становится двусторонним, присоединяется дрожание стоп, челюсти, языка, век. Редко возможен дебют с асимметричного, одностороннего тремор покоя стоп;
· вегетативные расстройства;
· аффективные нарушения;
· когнитивные дисфункции;
· психотические нарушения.
Гипокинезия:
· замедленностью движений;
· нарушением инициации;
· снижением скорости и амплитуды повторяемых движений;
· гипомимия;
· редкое мигание;
· замедленная речь (брадилалия);
· гипофоничная и монотонная речь;
· дисфагия с затруднением глотания слюны;
· утрата содружественных движений (ахейрокинез);
· шаркающая, короткими шагами походка;
· мелкий почерк (микрография);
· затруднения при поворотах в постели; · замедленность в повседневной активности.
Ригидность:
· скованность/чувство стягивания в шее, нижней части спины, в мышцах руки/ноги (в начале заболевания ригидность носит асимметричный, односторонний характер усиливается при отвлечении внимания/движениях в контралатеральной конечности);
· мышечный тонус вязкий, пластический, монотонный, усиливается при каждом повторном пассивном движении в процессе проверки (феномен «восковой куклы», феномен «свинцовой трубы») толчкообразно меняется (феномен «зубчатого колеса»).
Постуральная неустойчивость:
· нарушение способности удерживать равновесие тела/ходьбе; Нарушение способности удерживать равновесие тела/ходьбе предрасполагает пациента к частым падениям чаще вперед, реже назад при ходьбе, поворотах на месте, вставании с кресла или постели. Для выявления позных нарушений проводят толчковую пробу на пропульсию/ретропульсию. В ранних стадиях БП затрудняются преимущественно тонкие движения в конечностях. Для выявления лёгкой степени гипокинезии можно попросить больного побарабанить пальцами по столу, постучать стопой о пол, быстро сжимать и разжимать кулаки, пронировать и супинировать предплечья. Следует обращать внимание на асимметрию движений, на феномен «истощаемости» (декремент) – замедление движения при его повторении с уменьшением амплитуды.
Немоторные симптомы БП.
1. Вегетативные расстройства, как на ранней, так и, особенно, в развёрнутой стадии: запоры; ортостатическая гипотензия; недержание мочи и кала; эректильная дисфункция; слюнотечение; слезотечение; расстройство терморегуляции; нарушение потоотделения (гипогидроз/гипергидроз); себорея.
2. Сенсорные расстройства в виде ощущения покалывания, онемения, жжения, зуда (50% пациентов); нарушение обоняния (90% пациентов).
3. Психические нарушения (развернутой стадии). · возможно депрессия и тревога (на ранней стадии). · возможно развитие обсессивно-компульсивного синдрома (на поздней стадии).
4. Когнитивные нарушения легкой и умеренной степени выраженности в первые 5 лет отмечаются у большинства больных. Признаки деменции появляется спустя 5 лет и более, крайне редко в первые годы болезни. Расстройства сна – обусловлены как самой БП (пробуждение в ночное время вследствие ригидности и гипокинезии), так и побочным действием лекарств, особенно АДР (дневная сонливость, приступы внезапного засыпания). Психотические нарушения (галлюцинации, иллюзии, бредовые расстройства, нарушение идентификации, делирий) могут возникать у 20—30% больных на любой стадии болезни и в любом возрасте, но чаще у пожилых пациентов с поздней стадией БП, у больных акинетико-ригидной формой и постуральной неустойчивостью в сочетании с деменцией.
Острая декомпенсация БП:
· нарастание основных клинических проявлений паркинсонизма, особенно гипокинезии, ригидности, постуральной неустойчивости;
· нарушение речи (вплоть до анартрии) и глотания;
· усиление моторных флуктуаций и дискинезий;
· психические расстройства (спутанность сознания, галлюцинации, параноидный бред, кататония);
· вегетативная нестабильность (ортостатическая гипотензия, нарушения сердечного ритма, терморегуляции, потоотделения, моторики ЖКТ, мочеиспускания);
· разновидность декомпенсации – акинетический криз, характеризующийся резким нарастанием гипокинезии и ригидности с развитием обездвиженности, анартрии и нарушения глотания, а также акинетико-гипертермический (злокачественный) синдром, для которого, помимо проявлений акинетического криза, характерна гипертермия (гиперпирексия), вызванная дисфункцией гипоталамуса. Сопровождающееся существенным ограничением функциональных возможностей пациента и сохраняющееся более 24 часов, несмотря на продолжение/возобновление привычной для пациента противопаркинсонической терапии.
Алгоритм диагностики паркинсонизма.
В диагностическом алгоритме БП (рис.12) можно выделить два этапа.
Первый этап – установление синдрома паркинсонизма и дифференциальная диагностика его с внешне сходными состояниями, в том числе эссенциальным/дистоническим тремором, аффективными нарушениями (апатия, депрессия, абулия), паратонией, истерией, апраксией ходьбы (лобной дисбазией) при сосудистых поражениях головного мозга/гидроцефалии, гипотиреозом.
Второй этап предполагает установление нозологического диагноза паркинсонизма и дифференциальную диагностику БП с другими заболеваниями, вызывающими этот синдром.
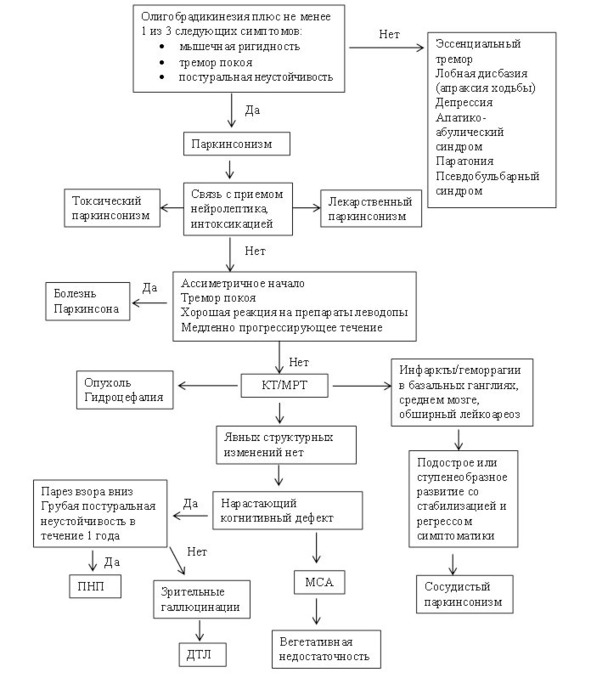
Рис. 12. Алгоритм диагностики паркинсонизма (ДТЛ – деменция с тельцами Леви, ПНП – прогрессирующий надъядерный паралич, МСА – множественная системная атрофия).
Для клинической диагностики БП используют критерии Банка головного мозга Общества болезни Паркинсона Великобритании. С помощью данных критериев можно установить лишь вероятный диагноз (при наличии не менее трех признаков, относящихся к третьей группе) или возможный диагноз (при наличии менее трех признаков) БП. Достоверный диагноз БП возможен лишь по данным патоморфологического исследования.
Критерии Банка Головного мозга Общества Болезни Паркинсона Великобритании (UK Parkinson’s Disease Society Brain Bank Clinical Diagnostic Criteria)
В настоящее время диагноз БП ставится в соответствии с утвержденными клинико-диагностическим критериям Банка головного мозга общества БП Великобритании (Gibb, Lees, 1988, 2009). Диагностика основана на оценке клинических критериев: наличие синдрома паркинсонизма, отсутствие признаков, исключающих БП и наличие признаков, подтверждающих диагноз. Данные критерии обладают высокой специфичностью (в 98% случаев в дальнейшем подтверждается БП), чувствительность данных критериев приближается к 90%, что означает, что лишь в 10% случаев БП не выставляется при ее наличии.
I этап. Cиндром паркинсонизма.
– Гипокинезия.
+ один из симптомов
– Мышечная ригидность;
– Тремор покоя;
– Постуральная неустойчивость, не связанная с первичными зрительными.
II этап. Критерии исключения болезни Паркинсона вестибулярными, мозжечковыми и проприоцептивными нарушениями.
– Повторные инсульты в анамнезе со ступенеобразным прогрессированием симптомов паркинсонизма;
– Повторные ЧМТ в анамнезе;
– Энцефалит в анамнезе;
– Окулогирные кризы;
– Лечение нейролептиками на момент появления симптомов;
– Семейный характер болезни;
– Наличие длительной ремиссии;
– Односторонняя симптоматика более 3 лет;
– Паралич взора вниз;
– Ранняя быстро прогрессирующая вегетативная недостаточность;
– Мозжечковые знаки;
– Рано развивающаяся деменция с нарушением памяти, речи и праксиса;
– Симптом Бабинского;
– Наличие сообщающейся гидроцефалии на КТ;
– Отсутствие реакции на высокие дозы леводопы;
– Контакт с токсическими веществами, вызывающими паркинсонизм.
III этап. Критерии, подтверждающие диагноз болезни Паркинсона.
– Одностороннее начало;
– Тремор покоя;
– Прогрессирующее течение;
– Сохранение асимметрии симптоматики с преобладанием на первоначально вовлеченной стороне;
– Высокая эффективность леводопы;
– Хореоформные дискинезии, индуцируемые леводопой;
– Сохранение реакции на леводопу в течение 5 лет и больше;
– Течение заболевания 10 лет и больше.
Методы нейровизуализации.
Изменения, выявляемые у пациентов с БП при проведении компьютерной томографии (КТ) и/или МРТ в стандартных режимах являются весьма неспецифичными. Преимущественно по данным нейровизуализации выявляется различной степени выраженности уменьшение объема вещества головного мозга: конвекситальная атрофия корковых отделов мозга, расширение желудочковой системы, которые не являются патогномоничными признаками этой патологии (рис. 13).
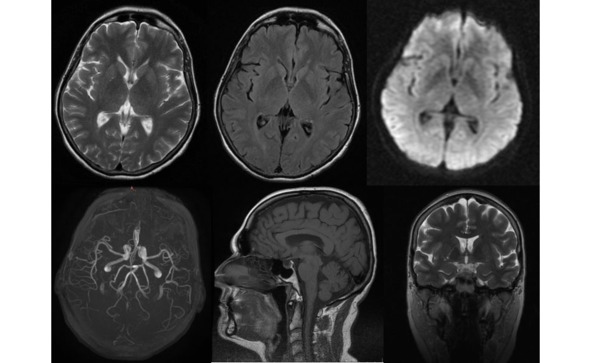
Рис. 13. Пример МР-томограмм пациентки 59 лет с БП.
Боковые желудочки мозга не расширены, симметричны (D=S). III-й и IV-й желудочки обычной конфигурации и размеров. Супраселлярная цистерна пролабирует в полость турецкого седла, остальные базальные цистерны не изменены. Субарахноидальные ликворные пространства неравномерно расширены по конвекситальной поверхности в проекции лобных, теменных долей и Сильвиевых щелей. Незначительно расширены периваскулярные пространства Вирхова-Робина по ходу пенетрирующих сосудов. Срединные структуры не смещены. Вертикальный размер гипофиза – до 0,3 см, сохраненная ткань гипофиза имеет обычный МР сигнал.
Более выраженные МР-признаки атрофии отмечаются у пациентов с акинетикоригидной формой заболевания, а также при наличие в клинической картине значительных когнитивных нарушений. Выраженность атрофии нарастает и по мере увеличения тяжести и продолжительности заболевания. Так, при длительности БП до 3 лет атрофия выявляется у трети пациентов, а при длительности свыше 6 лет возрастает более чем в 2 раза и отмечается у 78% пациентов.
Несмотря на то что МРТ в стандартных режимах не выявляет каких-либо патогномоничных признаков при БП, этот метод позволяет исключить другие структурные поражения мозга, сопровождающиеся синдромом паркинсонизма. К таким патологиям относятся опухоль базальных ганглиев, нормотензивная гидроцефалия, сосудистые поражения, изменения сигнала от базальных ганглиев вследствие болезни Вильсона-Коновалова, отравления марганцем и др. МРТ помогает также в дифференциальной диагностике БП с паркинсонизмом вследствие нейродегенеративных заболеваний, при каждом из которых МРТ имеет ряд специфических симптомов: «глаза тигра» (рис. 14).
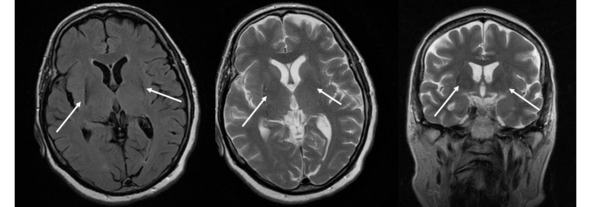
Рис. 14. Пример МР-томограмм пациентки 69 лет с «нейродегенерацией с отложением железа в мозге» (NBIA-Syndrom – Neurodegeneration with Brain Iron Accumulation). В проекции базальных ганглиев (отмечены стрелками) выявляются симметричные вытянутые зоны изменения МР-сигнала, неоднородного гипоинтенсивного МР-сигнала на Т2ВИ, Flair, изоинтенсивные на Т1 ВИ, что может соответствовать накоплению железа в базальных ганглиях.
Попытки оценки изменений нейронов в черной субстанции при БП в настоящее время продолжаются с использованием новейших методик нейровизуализации, в том числе МРТ-морфометрии. Этот метод получил распространение только в последнее десятилетие в связи с внедрением в клиническую практику режимов высокого разрешения и появлением метода воксельных преобразований трехмерных данных (VBM-voxel-based morphometry). Оценка объема черной субстанции при МРТ-морфометрии пока не показала значимого уменьшения объема черной субстанции у пациентов с БП, возможно, вследствие трудностей в выделении границ черной субстанции. При БП диффузионная тензорная МРТ выявляет специфичное для данного заболевания снижение фракционной анизотропии в каудальных отделах черной субстанции. По данным D. Vaillancourt, этот признак с 100%-ной специфичностью позволяет дифференцировать БП от группы контроля и может являться дополнительным диагностическим критерием, подтверждающим БП. Полученные D. Vaillancourt результаты согласуются с патоморфологическими посмертными исследованиями у пациентов с БП, выявляющими наибольшую потерю нейронов в вентрокаудальной части черной субстанции. Диффузионно-тензорная МРТ позволяет выявлять микроструктурные поражения белого вещества при наличии когнитивных нарушений и оценивать их по снижению фракционной анизотропии. Методика диффузионно-взвешенной МРТ обладает большей специфичностью по сравнению со стандартными режимами МРТ и позволяет провести дифференциальный диагноз между паркинсонизмом при нейродегенеративных заболеваниях и БП. Программа DWI выявляет увеличение коэффициента диффузии в скорлупе и в области лентикулярных ядер в 80—90% случаев клинически возможной МСА и прогрессирующего надъядерного паралича (ПНП), в то время как у пациентов с БП в этих зонах он остается в пределах нормы.
Депигментация черной субстанции и голубого пятна – значимая патологическая характеристика БП; она связана с потерей нейромеланина, парамагнитные свойства которого приводят к повышению магнитно-резонансного (МР) сигнала на Т1-взвешенных изображениях. Недавними исследованиями было показано, что уменьшение содержания нейромеланина в черной субстанции и голубом пятне при БП может рассматриваться в качестве потенциального биомаркера заболевания. В связи с этим в работе, проведенной в Португалии, оценивалась диагностическая значимость МР-визуализации нейромеланина у пациентов с БП, при этом впервые был использован метод полуавтоматического анализа МР-изображений.
В исследование включались пациенты с БП, диагностированные de novo и не получавшие лечение с длительностью заболевания от 2 до 5 лет. Кроме пациентов с БП была сформирована сопоставимая по возрасту контрольная группа. В исследовании для визуализации нейромеланина использовалась МРТ высокого разрешения 3 Тесла в режиме Т1. Основными исследуемыми переменными были выбраны площадь повышенного сигнала в области черной субстанции, его длина, отношение нейромеланин/средний мозг, полученные с помощью метода полуавтоматической оценки.
Суммарно в исследование были включены 12 впервые диагностированных пациентов с БП и 10 пациентов с длительностью заболевания от 2 до 5 лет. Площадь, длина повышенного сигнала в режиме Т1 от области черной субстанции и отношение нейромеланин/средний мозг были статистически значимо ниже в группе БП по сравнению с контрольной группой, при этом в двух подгруппах заболевания данные показатели существенно не различались. Нейромеланин-чувствительная МР-методика позволяет отличать случаи БП от здоровых лиц с высокой чувствительностью и специфичностью. Полученные данные совпадают с более ранними результатами, свидетельствующими о стабильности содержания нейромеланина в процессе заболевания.
По результатам Stefan T. Schwarz при выполнении МРТ головного мозга на аппаратах повышенной мощности (7 Тесла) и разрешающей способности удается обнаружить структурные изменения тканей мозга в центральной зоне substantia nigra, характерные для людей с БП. В ходе наблюдений было выявлено, что у здоровых людей эта область напоминает изображение хвоста ласточки (рис. 15). У пациентов с БП характерное разделение черной субстанции на две доли «ласточкиного хвоста» пропадает. Для проверки своего метода ученые провели 114 сканирований головного мозга с высоким разрешением. В 94% случаев им удалось поставить точный диагноз. Дальнейшие исследования показали, что «ласточкин хвост» (и его отсутствие) можно разглядеть и на аппаратах мощностью 3 Тесла.
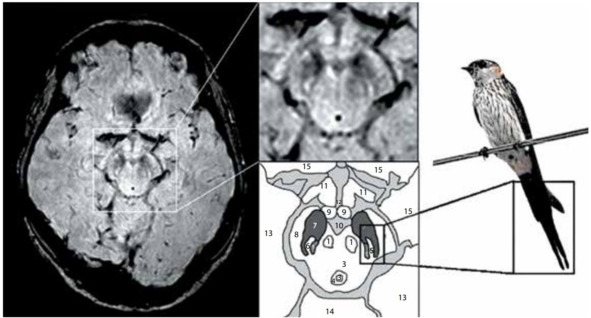
Рис. 15. МРТ (3 Тл, SWI) здорового человека, аксиальный срез на уровне нигросомы 1 с увеличением среднего мозга (справа, сверху) и схематическим изображением соответствующих анатомических структур (справа, снизу): 1 – красное ядро, 2 – покрышка среднего мозга, 3 – водопровод, 4 – периводопроводное серое вещество, 5 – медиальная петля, 6 – нигросома 1, 7 – черное вещество, 8 – ножки мозга, 9 – сосцевидное тело, 10 – интерпедикулярная ямка, 11 – зрительная лучистость, 12 – третий желудочек, 13 – височная доля, 14 – мозжечок, 15 – лобная доля [Schwarz S.T et al., 2014].
Транскраниальная сонография.
Транскраниальная сонография (ТКС) относится к новым нейровизуализационным методикам, позволяющим выявлять структурные изменения черной субстанции. ТКС представляет собой ультразвуковое исследование вещества головного мозга в В-режиме. ТКС как метод инструментальной диагностики экстрапирамидных заболеваний получил свое развитие в течение последнего десятилетия в связи с появлением нового поколения ультразвуковых аппаратов (рис. 16) с высоким качеством изображения, которое позволило идентифицировать нейроанатомические структуры небольших размеров, патология которых лежит в основе этих заболеваний.
В 1995 г. G. Becker et al. было опубликовано первое описание применения ТКС у пациентов с БП. В работе был выявлен характерный для БП феномен – гиперэхогенность черной субстанции (ГЧС). На сегодняшний день ГЧС является основным, наиболее надежным и воспроизводимым, ультразвуковым биомаркером БП на всех стадиях заболевания.
Физические принципы ТКС, основанные на отражении УЗ-волн от неоднородных структур, обладающих различным акустическим сопротивлением (В-режим), позволяют выявлять характерные изменения черной субстанции, шва мозга, базальных ганглиев, ядер мозжечка, которые невозможно определить иными нейровизуализационными методами с другими физическими принципами получения изображения.

Рис. 16. Аппарат транскраниальной сонографии.
Преимуществами метода ТКС являются неинвазивность, широкая доступность в клинической практике, короткое время и относительно невысокая стоимость исследования, возможность проведения неограниченного количества исследований без риска для здоровья пациента. Кроме того, ТКС не зависит от двигательной активности пациентов, что особенно важно для больных с экстрапирамидными расстройствами и с гиперкинетической активностью. В связи с этим ТКС представляется перспективным инструментальным методом для скрининга и рутинной диагностики заболеваний.
Исследование выполняется через транстемпоральный доступ при расположении датчика в преаурикулярной области. Структуры ствола мозга, базальные ганглии и желудочки визуализируются в трех стандартизированных плоскостях сканирования. Для этих плоскостей разработаны четкие УЗ-ориентиры и определены углы наклона датчика. Для визуализации структур мозга используется фазированный датчик с частотой 2,5 МГц. Устанавливается глубина 140—160 мм, динамический диапазон 45—50 dB. Яркость и контрастность выставляются индивидуально для каждого конкретного случая. Обследование обычно начинают с аксиальной плоскости, параллельной орбитомеатальной линии (линия от наружного края глаза до наружного слухового отверстия). В этой плоскости средний мозг визуализируется в виде «бабочки», окруженной эхогенными базальными цистернами. В плоскости сканирования среднего мозга оцениваются ипсилатеральная область черной субстанции, красное ядро и шов мозга. Особенно тщательно должна быть исследована область черной субстанции в проекции ножек среднего мозга на предмет гиперэхогенности, которая может быть представлена в виде пятна или полосы. Черная субстанция обычно имеет низкую эхогенность и не отличается по УЗ-параметрам от окружающего ее вещества мозга. На настоящий момент считается, что количественная оценка площади ГЧС предпочтительней, нежели качественная оценка интенсивности эхосигнала, так как последняя зависит от ряда изменяемых параметров.
ГЧС признается, если интенсивность УЗ-сигнала от нее превышает таковую от окружающих областей или измеренная площадь превышает нормальные значения, полученные в популяционных исследованиях (более 0,20 см2). В большинстве проведенных независимых исследований ГЧС выявлялась более чем у 85—92% пациентов с БП. Часть исследователей отмечают, что на начальных стадиях БП гиперэхогенность более выражена на стороне, контрлатеральной двигательным нарушениям. В исследовании D. Berg размер ГЧС не коррелировал с выраженностью моторных симптомов и оставался стабильным в течение 5 лет наблюдения, несмотря на прогрессирование симптомов. В связи с этим D. Berg было высказано предположение о том, что ГЧС является биомаркером функциональной несостоятельности черной субстанции и отражает скорее накопление железосвязанных белков, а не гибель дофаминпродуцирующих нейронов. Кроме того, ряд исследований выявил взаимосвязь ГЧС с уровнем ферритина и обратную взаимосвязь с уровнем нейромеланина в черной субстанции. У единичных пациентов с БП и ГЧС выявлены полиморфизмы в генах, участвующих в метаболизме железа, однако ни один из известных на сегодняшний день генов, ассоциированных с БП, напрямую не участвует в метаболизме железа. Несмотря на наличие нигральной дегенерации на аутопсии при МСА и ПНП, этот феномен выявляется при этих заболеваниях только в 25% случаев.
Радиоизотопная компьютерная визуализация: ПЭТ и ОФЭКТ.
ПЭТ с применением специфического лиганда F18-флюородопы позволяет количественно определять дефицит синтеза и хранения допамина в пределах пресинаптических стриарных терминалей. Количество пресинаптичесикх дофаминергических терминалей при БП прогрессивно уменьшается, что выявляется при проведении ПЭТ. При БП происходит уменьшение захвата F18-флюородопы нейронами скорлупы на стороне, противоположной моторным симптомам. Критерий БП – снижение захвата F18-флюородопы в скорлупе на 30% и более. Этот признак, отражающий дегенерацию нигростри-арных нейронов, нередко встречается и при МСА и других нейродегенеративных заболеваниях, но при МСА, ПНП, кортико-базальной дегенерации (КБД) уже на ранней стадии снижается захват этого лиганда и в хвостатом ядре, что не характерно для БП. Оценить состояние постсинаптических дофаминовых рецепторов можно с помощью ПЭТ с лигандом Dj-рецепторов раклопридом. При БП плотность Dj-рецепторов бывает нормальной или повышенной за счет механизмов нейропластичности и незначительно снижается лишь на фоне длительного приема дофаминергических препаратов. При паркинсонизме вследствие других нейродегенеративных заболеваний (МСА, ПНП и КБД) количество постсинаптических дофаминовых рецепторов в полосатом теле уменьшается.







