
Алексей Москалев
Как победить свой возраст? Восемь уникальных способов, которые помогут достичь долголетия
Уровень накопления клетками повреждений, мутаций и хромосомных аберраций служит эффективным маркером скорости старения. Существуют различные лабораторные методы, позволяющие оценить состояние клеток организма (рис. 3).
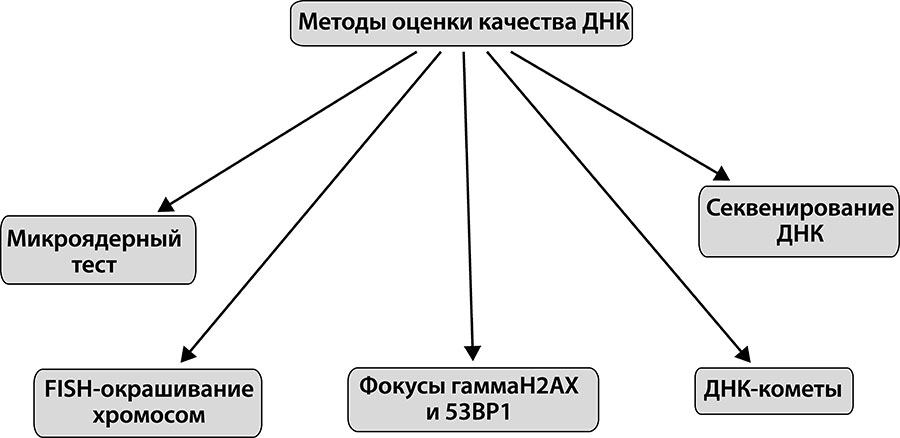
Рис. 3. Методы оценки количества повреждений ДНК.
Микроядра – патологические структуры внутри клеток, как правило, возникающие вокруг отставших во время деления обломков хромосом. Они выявляются при специальном окрашивании клеток и их анализе под световым микроскопом. С возрастом количество клеток, имеющих микроядра, становится больше, например, среди лейкоцитов[51] крови или клеток кожи. Чем быстрее стареет организм, тем в более раннем возрасте наблюдается увеличение количества таких клеток.
Исследование с помощью люминесцентного микроскопа[52] светящихся (флуоресцентных) ДНК-зондов[53], имеющих сродство к тем или иным участкам хромосом человека, позволяет выявлять тонкие перестройки (транслокации, делеции, дупликации) в каждой из 46 хромосом человеческой клетки. Этот метод получил название FISH-окрашивания хромосом.
Еще один маркер старения – двухцепочечные разрывы ДНК, как правило, вызывающие фатальные для клетки повреждения либо ведущие к генетической нестабильности и опухолевому перерождению. Однако именно их с возрастом становится все больше и больше. Специальное гистохимическое окрашивание (так называемые фокусы гамма-H2AX и 53BP1) позволяет подсчитать под люминесцентным микроскопом число таких разрывов на ядро и тем самым оценить скорость старения изучаемой ткани (в молодых клетках обычно нет таких разрывов, хотя они могут появиться при действии на организм ионизирующей радиации).
При наличии повреждений молекула ДНК становится более подвижной в электрическом поле. Круглое ядро клетки с поврежденной ДНК при электрофорезе[54] становится вытянутым, а мелкие фракции разорванной ДНК формируют при этом «хвост кометы». Чем более выражен хвост, тем более повреждена клеточная ДНК. Данный метод имеет различные модификации, позволяющие полуколичественно (не поштучно, но с помощью конкретного числового показателя) учитывать разные типы повреждений – одно- и двухцепочечные разрывы ДНК, различные окисленные основания ДНК. Наши исследования, проведенные на клетках периферической крови, бравшейся прижизненно у мышей разного возраста, доказали возможность применения данного подхода для оценки интенсивности старения организма. Таким образом, устойчивость к повреждению, как и стрессоустойчивость в целом, в результате старения падает.
Выделенные из крови человека лимфоциты можно культивировать в лаборатории. Показатели гибели клеток, индуцированной повреждением ДНК или иммунной активацией, являются отличными маркерами скорости старения данного человека.
Собственно, мутации[55] позволяет выявлять метод секвенирования ДНК – побуквенного прочтения закодированной генетической информации. Накопление с возрастом одно- или многобуквенных изменений последовательности ДНК в жизненно важных генах – фактор старения или озлокачествления клетки.
С каждым делением клетки хромосомы укорачиваются с обоих концов. Концы хромосом защищены особыми «заглушками» – теломерами. Однако, когда теломеры укорачиваются и утрачиваются при многократном копировании ДНК, хромосомы начинают сливаться друг с другом, разрываться и индуцировать ответ клетки на повреждение, заканчивающийся выходом клетки из цикла делений или гибелью клетки. Как показали исследования под руководством нобелевского лауреата Э. Блекберн, длина теломер некоторых клеток крови (лимфоцитов) – надежный показатель скорости старения. Многолетние измерения показали, что люди с более короткими теломерами отличаются более высокими темпами старения, повышенной вероятностью сердечно-сосудистых проблем, рака и возрастзависимой макулярной дегенерации (форма старческой слепоты). Укорочению теломер способствует высокий уровень стрессовых гормонов (кортизола, адреналина, норадреналина) и курение.
В некоторых клетках тела функционирует особый фермент – теломераза, достраивающий теломеры. В норме он позволяет предшественникам половых клеток и стволовым[56] (а также раковым) клеткам делиться бесконечно. Количество теломеразы можно оценивать в лейкоцитах или стволовых клетках и тем самым предсказывать скорость старения. Измерение количества теломеразы в клетках крови, имеющих ядра (у эритроцитов, например, ядер нет), позволяет предсказывать не только состояние ускоренного старения, но и вероятность смерти от сердечно-сосудистых патологий.
Как показала группа Х. Джианг, дисфункция теломер и повреждение ДНК с возрастом отражаются на уровне определенных стресс-белков в плазме крови (CRAMP[57], статмина[58], EF-1[59], хитиназы[60]). Данные изменения, помимо старения, проявляются при миелодиспластическом синдроме[61], IgA-нефропатии[62] и циррозе печени[63].
Повреждение ДНК вызывает в клетках каскад процессов, в результате которых клетки полностью утрачивают способность к делению. Это происходит из-за активации некоторых генов, таких как p16, блокирующих цикл клеточного деления. Изначально это явление возникло для предотвращения размножения предраковых клеток, однако теперь оно играет существенную роль в процессах старения человека. Как было показано, уровень активности гена p16 нарастает в иммунных Т-клетках периферической крови с возрастом, причем данный процесс протекает более интенсивно у курильщиков, что свидетельствует об их ускоренном старении.
На субклеточном уровне при старении также наблюдаются стойкие изменения. Живая клетка состоит из двух главных составляющих – ядра и цитоплазмы. В ядре клетки сосредоточен хроматин – наследственный материал, состоящий из ДНК и связанных с ней белков. Ядро выполняет функцию хранения и защиты по отношению к ДНК, а его оболочка служит своеобразным ситом, избирательно пропускающим макромолекулы из цитоплазмы в ядро и обратно. Таким образом, его значение в жизнедеятельности клетки трудно переоценить. Оболочка клеточного ядра подстилается каркасом из особых белков – ламинов. Поскольку ламины помогают концам хромосом заякориться в оболочке ядра и участвуют в правильной упаковке хроматина, то нарушение соотношений ламинов ведет к дестабилизации наследственного материала или гибели клеток. Дети с дефектом гена ламина А (синдром Хатчинсона – Гилфорда) к 12 годам приобретают все признаки глубокой старости. Изменение соотношения различных вариантов ламинов при обычном старении сопровождается отклонением формы ядер от нормы. Ядра вместо ровной округлой формы могут приобретать выпуклости или пузырьки на своей поверхности. Данные изменения можно наблюдать под световым микроскопом и таким образом учитывать долю старых клеток в образце. Окрашивание клетки при помощи антител[64] к ламинам A/C позволяет рассмотреть и подсчитать необычные ядра под люминесцентным микроскопом.
Митохондрии – энергетические станции клеток, вырабатывающие в необходимых количествах энергетическую валюту – молекулу АТФ[65], постепенно утрачивают целостность своей ДНК. В одной митохондрии может быть несколько молекул митохондриальных ДНК (мтДНК). Свободные радикалы, местом образования которых являются митохондрии, окисляют основания в цепочке мтДНК, например, гуанозин[66]. В результате возникают точечные (однобуквенные) мутации, которые наравне с выпадением участков мтДНК (делециями) приводят к сбоям в способности митохондрий к делению и образованию АТФ. МтДНК, имеющая делеции, легче удваивается, так как она короче, процесс ее репликации[67] менее энергозатратен, в результате чего дефектные митохондрии заполоняют стареющие клетки, например, мышц и нейронов мозга (в них больше всего митохондрий), вызывая саркопению и нейродегенерацию. Возникающий недостаток АТФ и других видов энергетической валюты клетки (НАДН[68], ФАД[69]), преимущественно образующихся в митохондриях, способствует угнетению функциональных способностей тканей, ростовых и репарационных процессов.
Как показали исследования Д. Аркинга, оценка количества мтДНК, приходящейся на одну клетку в образцах крови, позволяет определять качество митохондрий и довольно точно предсказывать биологический возраст. В то время как количество клеточной мтДНК с возрастом снижается, уровень свободно циркулирующей в крови мтДНК (по данным К. Франчески) возрастает. Свободно циркулирующая кольцевая мтДНК – маркер клеточного распада. В крови она подвергается окислению, становится похожей на бактериальную кольцевую ДНК и поэтому вызывает воспалительные процессы в организме, активируя рецепторы TLR9[70] клеток.
Старые клетки постепенно забиваются «мусором», состоящим из поврежденных митохондрий и агрегатов окисленных и денатурированных белков. Клетка пытается задействовать все большее количество лизосом для их переваривания. Поэтому такие клетки начинают прокрашиваться на лизосомальный[71] фермент – возрастзависимую бета-галактозидазу[72].
В соединительной ткани, эпителии[73] стенки кишечника и кожи, эндотелии[74] сосудов при старении происходит накопление клеток, утративших способность к делению. Это так называемое клеточное старение. Старые клетки не только отказываются выполнять свои функции, но и активно повреждают окружающую их ткань, провоцируют воспаление, угнетают стволовые клетки, стимулируют образование опухолей, разрушают межклеточный матрикс[75]. Тем не менее такие клетки продолжают расти в размерах и накапливать некоторые продукты своей жизнедеятельности – старческий пигмент липофусцин, амилоид (агрегаты поврежденных белков). Они имеют уплощенную форму и гигантские размеры. На срезе ткани их легко выявить и подсчитать при специальном окрашивании на бета-галактозидазу – фермент, связанный со старением.
Липофусцин был впервые описан в нейронах в 1842 году Х. Ганновером. Липофусцин является внутрилизосомным полимерным материалом, который не в состоянии разрушаться гидролитическими ферментами лизосом или выводиться из клетки и организма. Это коричнево-желтый пигмент, который состоит из сшитых поперечно остатков белков, которые образуются в присутствии катализатора – ионов железа. Помимо белков (30–70 %) на 20–50 % липофусцин состоит из окисленных липидов, а также включает в себя следовые количества углеводов и металлов. Железо в кислой среде лизосом способствует образованию избыточного количества активных форм кислорода, которые приводят к вшиванию белков и липидов в неперевариваемый липофусцин, который считается важным признаком старения. Липофусцин с возрастом накапливается в ткани мозга, сердца, сетчатке глаза. Его можно измерить в качестве биомаркера старения в крови. В марте 2015 года Фу-Куи Фенг и коллеги показали, что уровень липофусцина, измеренный в слюне, хорошо коррелирует с возрастом пациента. Это делает тест на содержание липофусцина безболезненным и более доступным, чем многие другие.
Повреждение ДНК и эпигенетические нарушения[76] приводят к изменению спектра белков в составе вещества хромосом (хроматина) и пространственной укладки хромосомного материала. Например, ядра старых клеток в избытке содержат участки, окрашиваемые иммуноцитохимически на такие белки, как гистон гамма-H2AX, 53BP1 (это маркеры разрывов нитей ДНК), а также PML и HIRA, формирующие участки сверхплотной упаковки ДНК. Последние изменения делают неактивными гены, важные для клеточного деления и роста.
Одной из наиболее доступных для оценки скорости старения тканей является кожа. Происходящие в ней изменения во многом отражают изменения эндокринной и нервной регуляции функций тела при старении, статус иммунной защиты. Легко извлекаемые из кожи фибробласты можно культивировать в лаборатории и оценивать по параметрам их жизнедеятельности общий уровень старения организма.
Системные изменения затрагивают гормональный фон, состояние нервной и иммунной систем. Статус иммунной системы определяет не только то, как часто мы болеем простудными заболеваниями. Возрастной спад одних сторон иммунитета и гиперактивация других является причиной аутоиммунных заболеваний (ревматоидного артрита[77], тиреоидита[78], болезней поджелудочной железы), аллергий, онкологических заболеваний, хронических воспалительных процессов.
Иммунные изменения
Респираторные инфекции, грипп и пневмония – ведущие причины смертности среди людей старше 65 лет во всем мире. С возрастом существенно падает эффективность ответа на вакцинацию, снижается способность красного костного мозга продуцировать стволовые клетки, дающие начало новым Т- и B-клеткам иммунной системы. Постепенно происходит инволюция[79] тимуса – вилочковой железы. Этот орган играет ключевую роль в образовании и обучении новых Т-клеток иммунной системы. В результате количество новых (так называемых наивных) Т-клеток резко снижается, и организм хуже справляется с новыми вызовами – инфекциями и опухолевыми процессами. Степень инволюции тимуса при старении можно оценить, измеряя в крови уровень особых кольцевых ДНК (sjTRECs), возникающих как побочные продукты созревания Т-лимфоцитов.
Функция тимуса дольше сохраняется у женщин, чем у мужчин. Иммунный ответ у женщин также формируется лучше.
Напротив, возрастает доля макрофагов[80], участвующих в воспалении и атеросклерозе.
Растет доля CD8+CD28— Т-лимфоцитов, маркеров перенапряжения иммунной системы. Рецептор CD28 играет роль в активации Т-клеток антигенами[81] и участвует в делении Т-клеток. Его отсутствие, выражающееся в избытке CD8+CD28– клеток, подавляет иммунную функцию в организме. Эти клетки оказывают цитотоксическое действие[82] и являются источником воспалительных цитокинов[83]. С возрастом увеличивается чувствительность к факторам, способствующим гибели клетки, у Т-клеток памяти[84], что вызывает постепенную утрату приобретенного иммунитета.
Хроническая стимуляция антигенами способствует ускоренному иммуностарению. Например, показано, что сокращению продолжительности жизни способствует длительное скрытое инфицирование цитомегаловирусом, вирусами герпеса человека. Напротив, низкий груз патогенов (вирусов, болезнетворных бактерий, грибов и простейших) – залог более медленной скорости старения и долголетия.
В старости во много раз увеличивается количество аутоантител – иммунных белков, атакующих собственные ткани. К ним относятся: ревматоидный фактор[85], антиядерные (атакующие хромосомы клеточного ядра), антитиреоидные (разрушающие щитовидную железу), антинейтрофильные (против клеток воспаления – нейтрофилов) антитела и антитела к кардиолипину (основному компоненту стенок энергетических станций клеток-митохондрий). В результате в пожилом возрасте нередки случаи ревматоидного артрита и гипотиреоза[86], наблюдается пик проявления системной красной волчанки.
Уровень многих цитокинов[87] подвержен изменениям, зависящим от возраста. В плазме крови[88] растет концентрация факторов, способствующих воспалительным реакциям, к которым относятся C-реактивный белок, TNF-α, МСР-1, интерлейкины-1, 6, 8, белки системы комплемента СЗ и С4. В результате развивается атеросклероз, который приводит к ишемической болезни сердца, инфаркту миокарда. Уровень в плазме крови провоспалительного[89] хемокина CCL11 (эотаксина) также повышается у человека при старении, что отрицательно сказывается на нейрогенезе – образовании новых нейронов из клеток-предшественников. Увеличение уровней CCL11 подавляет нейрогенез в тех участках мозга, где он возможен, например, в гиппокампе[90], и поэтому нарушает способности к обучению и памяти. Противовоспалительные цитокины, важные для выполнения иммунной функции, наоборот, находятся в дефиците: интерферон-γ, интерлейкины-2, 7, 10.
Провоспалительный белковый профиль, обнаруживаемый в сыворотке крови, – характерный признак ускоренного старения. С хроническим воспалением связаны: сахарный диабет 2-го типа, образование опухолей и болезнь Альцгеймера.
Наряду со старением имеются сопутствующие факторы, снижающие иммунитет. В частности, депрессия, длительный психологический стресс, связанный с социальными факторами, общественной изоляцией, проблемами в семье. При хроническом стрессе вырабатывается гормон кортизол, подавляющий иммунитет. Отрицательную роль играют изнуряющая физическая работа, перегрев на солнце, переохлаждение отдельных участков тела. Иммунной системе, как и любой другой, для правильного функционирования требуются баланс и гармония. Работу иммунной системы может нарушить дефицит микронутриентов в пище (цинка, селена, фолиевой кислоты, витаминов В6, В2, С, А, D и Е), вызванный недоеданием, низким разнообразием питания и пониженным усвоением питательных веществ, часто свойственными стареющим людям. Стоит заметить, что избыток этих веществ также угнетает иммунитет. Недостаточное употребление белка уменьшает число и подавляет функционирование Т-клеток и макрофагов, сокращает выработку антител.
Специалисты Гарвардской медицинской школы выделили несколько простых правил, препятствующих снижению иммунитета:
Не курите.
Регулярно занимайтесь физкультурой.
Поддерживайте здоровый вес.
Контролируйте артериальное давление.
Умерьте потребление алкоголя.
Старайтесь высыпаться.
Закаливайтесь.
Избегайте соприкосновения с источниками инфекции – не контактируйте с простудными больными, часто мойте руки, подвергайте пищу достаточной термической обработке.
Регулярно сдавайте анализы на скрытые инфекции.
Снижайте уровень воспаления и избегайте источников его возникновения.
По мнению профессора Гарвардской школы общественного здравоохранения Ф. Ху, большинство продуктов питания, которые связаны с повышенным риском хронических заболеваний, таких как сахарный диабет 2-го типа, и сердечно-сосудистых заболеваний, также связаны с избыточным воспалением. Несбалансированные по составу продукты питания способствуют увеличению веса, что само по себе является фактором риска воспаления, так как жировая ткань выделяет большое количество воспалительных цитокинов. Воспалительные процессы возникают при употреблении жареной пищи (картошки фри и т. д.), сладкой газировки, рафинированных углеводов (белый хлеб, выпечка), маргарина, сала, красного и глубоко переработанного мяса (гамбургеры, стейки, сосиски, колбасы). Эти продукты могут содержать конечные продукты гликирования[91], насыщенные и окисленные жиры, вызывающие воспалительный ответ при попадании в организм.
Противовоспалительное действие на организм, напротив, оказывают томаты, фрукты и ягоды (яблоки, клубника, черника, апельсины, вишня), орехи (миндаль, грецкие орехи), оливковое масло, листовые овощи (шпинат, листовая капуста), жирная рыба (лосось, макрель, тунец, сардины), кофе, зеленый чай. Они содержат полифенолы, омега-3 и другие биологически активные вещества, подавляющие активность воспалительных ферментов.






