
Джейми Метцль
Взломать Дарвина: генная инженерия и будущее человечества
По мере того, как технологии становились точнее и мощнее, их стоимость стремительно снижалась. График ниже показывает, как резко снизилась стоимость секвенирования генома за последние 15 лет.
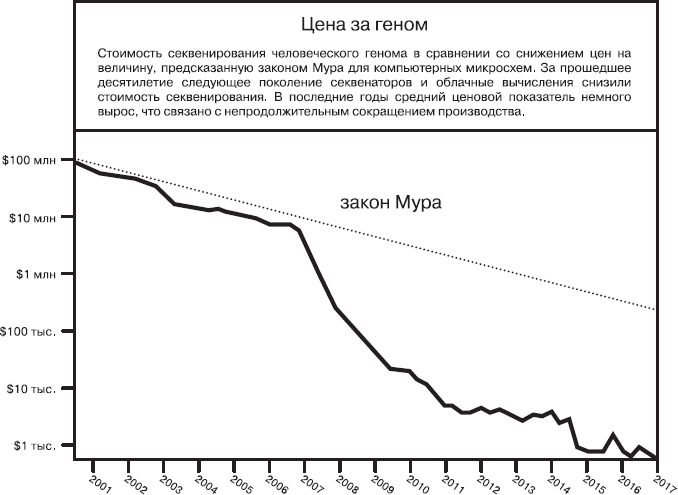
Источник: The Cost of Sequencing a Human Genome, NIH, дата последнего изменения 6 июля 2016 года, https://www.genome.gov/27565109/the-cost-of-sequencing-a-human-genome/.
Сегодня секвенирование всего генома выполняют за день, и оно стоит порядка 700 долларов. В начале 2017 года генеральный директор Illumina Фрэнсис де Соуза объявил, что в недалеком будущем его компания планирует секвенировать целый геном за 100 долларов. По мере того, как стоимость секвенирования приближается к затратам на материалы, а само секвенирование оказывается все более доступным, за меньшие деньги вы можете получить все больше данных. А поскольку геномика – это настоящий полигон для больших массивов данных, увеличение объема и удешевление данных заложат основу для важных открытий.
Но даже если секвенирование станет повсеместным, обыденным и бесплатным, это ничего не изменит, если ученые не научатся понимать язык геномов.
* * *
Если бы марсианка прилетела на Землю, желая выяснить, как люди структурируют информацию, ей бы пришлось узнать, что у нас есть определенные вещи, которые мы называем «книги». Затем ей пришлось бы понять, что такие книги состоят из страниц, которые заполнены словами, а те, в свою очередь, образуются из букв. Точно так же и мы узнали, что ДНК находится в генах, упакованных в хромосомы, кодирующие белки и инструктирующие клетки о дальнейших действиях. Если бы марсианка захотела понять, что сказано в книгах, ей пришлось бы разобраться, что означают слова и как их читать. Аналогично, когда ученые вывели основы организации генов, еще предстояло понять, чем на самом деле эти гены занимаются.
Хорошая новость заключается в том, что у ученых много козырей в рукаве. По мере того, как исследователи секвенировали геномы отдельных червей, мух, мышей и прочих сравнительно простых «модельных организмов», чтобы разобраться в общих биологических процессах, ученые пытали сопоставить различия между схожими типами организмов и непохожесть их генов. Сформулировав гипотезу, они стали выводить организмы с одинаковыми генетическими мутациями, чтобы выяснить, будут ли проявляться те же признаки у потомства. Со временем ученые научились включать и выключать различные гены в живых организмах и наблюдать, как в результате менялись отдельные признаки. Они использовали усовершенствованные вычислительные инструменты, чтобы анализировать взаимодействие генов, и проводили более масштабные исследования ассоциаций, чтобы обработать еще большие наборы генетических данных.
Даже если бы вся биология опиралась только на экспрессию генов, расшифровать наборы генетических данных было бы довольно трудно. Однако все намного сложнее. Сам по себе геном – это невероятно сложная экосистема, которая взаимодействует как с другими сложными системами внутри организма, так и с изменяющейся средой вокруг. Экспрессия одного гена приводит к проявлению только небольшого процента признаков или заболеваний. Большинство же из них обусловлено группой генов, работающих сообща и взаимодействующих с окружающей средой.
По сути, никто не знает точного числа, но было подсчитано, что в определении сложных признаков, например интеллекта, веса и типа личности, играют роль сотни или тысячи генов. Они не работают в одиночку. Рибонуклеиновая кислота, или РНК, которая когда-то считалась проводником между ДНК и клеточным механизмом по производству белка, теперь признана важным участником экспрессии. Эпигенетические метки помогают определить, как гены делают это. На первых этапах изучения геномики понять, как эти перекрестные процессы влияют на сложные генетические признаки, было необычайно сложно. И все же обозначить сравнительно небольшой процент признаков и болезней, обусловленных мутациями одного гена, было немного проще.
Муковисцидоз, болезнь Гентингтона, мышечная дистрофия, серповидно-клеточная анемия, болезнь Тея – Сакса – все это примеры заболеваний, вызванных мутацией одного гена. Также они известны как менделевские заболевания, потому что четко следуют законам генетического наследования. Какие-то из этих заболеваний называются доминантными, поскольку в этом случае ребенку достаточно унаследовать только одну копию мутации от родителя с той же патологией. В случае же таких рецессивных патологий, как болезнь Тея – Сакса, ребенок должен унаследовать мутацию от обоих родителей. (В редких случаях люди с подобными мутациями не наследуют определенное заболевание, чаще всего потому, что эту мутацию сдерживают другие гены.) Из примерно 25 000 уже известных менделевских заболеваний около 10 000 изучены на достаточном уровне, позволяющем связывать с проявлением определенного заболевания определенный ген[11]. На сегодняшний день лечению поддаются лишь 5 % подобных мутаций.
Менделевские заболевания очень редки. Например, в Америке с муковисцидозом рождается только 1 из 13 000 детей, 1 из 10 000 наследует болезнь Гентингтона и 1 из 7250 мужчин наследует мышечную дистрофию Дюшенна. Один из 365 афроамериканских детей рождается с серповидно-клеточной анемией. Эта болезнь чаще проявляется в группах людей, чьи недалекие предки жили в районах, где многие болели малярией. Остальные менделевские заболевания встречаются с частотой один на миллионы или даже десятки миллионов людей[12][13]. Многие из них приносят ужасные страдания и ведут к преждевременной смерти. Но ввиду их редкости в поиск лекарств от этих заболеваний общество в целом инвестирует менее охотно, по сравнению с более распространенными, например раком, сердечными и легочными заболеваниями, которые затрагивают прослойки населения с большей численностью, гласностью и политическим весом. Хотя ряд новых исследований предполагает, что различные варианты менделевских генов могут играть большую роль в возникновении таких распространенных заболеваний, как метастатический рак предстательной железы, эти предварительные данные пока не смогли изменить ситуацию с финансированием[14].
При таком большом количестве редких генетических заболеваний, которые вряд ли получат достаточно внимания и ресурсов, чтобы появились лекарства, родители и люди из группы риска, вдохновленные прорывами в генетических технологиях, стали самостоятельно искать способы защитить своих будущих детей.
* * *
Дети, рожденные с болезнью Тея – Сакса – генетическим заболеванием, обусловленным мутацией одного гена в 15-й хромосоме, – часто при рождении выглядят здоровыми. Но вскоре после рождения нервная система младенцев начинает разрушаться. К двум годам большинство детей страдают от страшных судорожных припадков и снижения умственных способностей. Многие лишаются зрения и перестают реагировать. Большая часть детей погибает в агонии, не дожив до пяти лет. Почти каждый 27-й еврей-ашкеназ является носителем мутации Тея – Сакса, и от этого заболевания ежегодно умирали сотни евреев по всему миру. Сегодня же оно почти не смертельно – благодаря чудесам науки и социальной организации.
В 1969 году ученые выделили ферменты, связанные с носительством болезни Тея – Сакса, и разработали специальный анализ крови, чтобы определять статус будущих родителей. Это всколыхнуло еврейские сообщества по всему миру. Общественные центры и синагоги в США, Канаде, Израиле, европейских и других странах начали проводить анализы. Пары, в которых оба будущих родителя оказывались носителями, получали рекомендации рассмотреть усыновление или провести анализы при беременности. Матери, у эмбрионов которых находили болезнь Тея – Сакса, почти всегда предпочитали прервать беременность – тяжелейший выбор, но, возможно, менее болезненный, чем смотреть, как их ребенок страдает и умирает. Ортодоксальные иудеи побуждали сватов генетически тестировать кандидатов, чтобы два носителя не вступали в брак.
В 1985 году секвенирование генов позволило выявить мутации, вызывающие болезнь Тея – Сакса, а затем были найдены и другие мутации этого гена. В наши дни болезнь Тея – Сакса – это чрезвычайно редкая среди евреев патология.
В свете хорошо зарекомендовавшего себя генетического сканирования на болезнь Тея – Сакса некоторые исследователи и политики начали продвигать идею расширенного тестирования на носительство для определения других категорий родителей, потенциально способных передать ребенку менделевские болезни или предрасположенность к ним[15].
Секвенирование генома и биохимическое измерение уровня ферментов оказались колоссальными научными достижениями, которые позволяли предотвратить передачу относительно простых генетических заболеваний. Однако сам по себе генетический анализ, не дополненный новыми способами применения знаний, не в состоянии изменить то, как люди создают детей. Сопутствующая революция в области экстракорпорального оплодотворения, или ЭКО, а также скрининг эмбрионов создали механизм, по которому генетический анализ мог бы в корне изменить процесс зачатия ребенка. Мы очень долго ждали таких открытий.[16]
* * *
В 1878 году, через 100 лет после эксперимента Спалланцани с презервативами для лягушек, Самуэль Леопольд Шенк из Вены, который по счастливой случайности учился в Венском университете одновременно с Грегором Менделем, изучал кроличьи яйцеклетки. Шенк заметил, что если он добавлял сперматозоиды к яйцеклеткам, изолированным в стеклянной пробирке, те начинали делиться. Это был ранний этап изучения процесса размножения, но Шенк правильно понял, что яйцеклетки оплодотворялись. То, что яйцеклетки млекопитающих получалось оплодотворить в посуде, позволяло предположить, что теоретически такие клетки можно имплантировать в материнский организм на весь срок беременности. Теоретически – возможно, но практически – пока что неосуществимо. Потребовалось еще 80 лет, чтобы американский ученый М. Ч. Чан успешно пересадил крольчихе яйцеклетку, оплодотворенную в посуде, или, по-латыни, in vitro. Но от вынашивания крольчонка до вынашивания младенца было все еще далеко. На это также требовалось время.
В 1968 году на исторически значимом собрании Королевского медицинского общества в Лондоне Роберт Эдвардс, исследователь в области биомедицины и один из ведущих экспертов по развитию человеческих яйцеклеток, подошел к изобретателю хирургической процедуры для обследователя женского таза – Патрику Стептоу. Эдвардс предложил совместно изучить, можно ли использовать искусственное оплодотворение для лечения бесплодия. Все последующее десятилетие двое ученых плодотворно трудились и опубликовали целую серию резонансных научных работ, описывающих каждый аспект того, что потребуется для успешного искусственного оплодотворения яйцеклетки человека.
В 1972 году Стептоу и Эдвардс приступили к клиническим испытаниям на людях. Вместе с медсестрой Джин Парди они аккуратно извлекли яйцеклетки из более чем 100 женщин, оплодотворили их спермой, а затем попытались хирургически имплантировать оплодотворенные яйцеклетки потенциальным матерям. Все эти попытки провалились. В 1976 году одна из женщин наконец-то смогла забеременеть, однако эта беременность прервалась, когда на ранних стадиях эмбрион прикрепился вне полости матки. Затем в 1977 году в клинику зашла Лесли Браун, домохозяйка из Бристоля, Англия. На протяжении девяти лет они с мужем Джоном, работником железной дороги, безуспешно пытались зачать ребенка и были в отчаянии.
Лесли забеременела после первой имплантации оплодотворенной яйцеклетки. Через девять месяцев, 25 июля 1978 года, на свет появилась здоровая девочка Луиза. Газеты всего мира писали о «ребенке века». Опрос американцев, прошедший пару месяцев спустя, показал, что об английском ребенке, зачатом вне организма матери, слышало шокирующее количество людей – 93 % опрошенных[17].
Хотя Луиза была зачата в стеклянной посуде, в сознании людей закрепилось мнение о том, что она и все дети вроде нее были созданы в пробирке. Это уничижительно прозвище – «дети из пробирки» – прочно закрепилось за ними. Многие люди, например большинство американцев, опрошенных исследовательским центром Пью в тот год, отнеслись к этому случаю положительно[18]. Другие же посчитали иначе. Католические богословы назвали процесс создания детей в пробирке «противоестественным» и «моральной гнусностью», поскольку само зачатие не включало в себя полового акта между мужем и женой, а неимплантированные эмбрионы шли в утилизацию[19].
Американская медицинская ассоциация сочла процесс зачатия в пробирке слишком агрессивным. Журнал Nova назвал это «величайшей угрозой после атомной бомбы». Ведущий специалист по биоэтике и консерватор Леон Касс заявил, что такой подход ставит под вопрос «идею человечности наших человеческих жизней, а также смысл нашей телесности, половой жизни и связи с предками и потомками»[20].
Лесли и Джон Браун получали множество писем с угрозами и забрызганных кровью посылок с пластиковыми эмбрионами внутри.
Но, как всегда и бывает, некогда шокирующий и неоднозначный процесс со временем стал приемлемым и вполне обычным. По мере того, как наука о создании «детей из пробирки» стала менее спорной и ей нашли более точное название, группа ученых начала задумываться о следующем этапе. Они задавались вопросом: почему нельзя извлекать клетки эмбриона, находящегося на ранних стадиях подготовки к имплантации при ЭКО, и секвенировать их с использованием современных технологий?
Уже в 1967 году первопроходец в области ЭКО Роберт Эдвардс и его британский коллега Ричард Гарднер описали, как удалили нескольких клеток из предымплантационного эмбриона кролика и изучили их под микроскопом, чтобы определить пол будущего кролика[21]. В 1990 году, через 12 лет после рождения Луизы Браун, врачи впервые успешно исследовали предымплантационный эмбрион человека, определив пол и проведя тесты на некоторые заболевания, связанные с половой принадлежностью или одногенными нарушениями. Такой тип скрининга стал известен как предымплантационная генетическая диагностика, или ПГД.
Технология ПГД развивалась быстро, особенно среди матерей из группы риска. Параллельно с ним развивался схожий процесс – предымплантационный генетический скрининг, или ПГС: эмбрионы без известных рисков заболевания тестировали, оценивая их шансы на успешное развитие. Не так давно ПГД и ПГС были объединены в семантическую группу предымплантационного генетического тестирования, или ПГТ.
ПГТ существует почти 30 лет, однако мы все еще стоим у истоков этой удивительной и важнейшей процедуры. Изначально ученые использовали ПГТ для первичной проверки на хромосомные аномалии, способные привести к выкидышу. Затем ученые попробовали выявить ограниченное число одногенных мутаций, вызывающих заболевания. Сегодня ПГТ широко используют, чтобы тестировать на ряд одногенных мутаций, общее число которых доходит до 10 000[22]. В отличие от пренатального тестирования эмбрионов в утробе матери, ПГТ можно делать на большом количестве оплодотворенных яйцеклеток, или бластоцист, в стекле.
В большинстве случаев болезни, на которые проводится ПГТ неимплантированных эмбрионов, по отдельности чрезвычайно редки. Но этого нельзя сказать о популяции в целом. Статистические данные разнятся, но недавние исследования показывают, что вероятность рождения ребенка – носителя генетического заболевания традиционным способом составляет 1–2 %[23]. При быстрорастущем количестве тестируемых заболеваний, вызванных одногенными мутациями, вероятность зачатия ребенка-носителя через ЭКО и ПГТ существенно снижается[24].
Число аномальных генетических особенностей, которых можно избежать с помощью ЭКО и ПГТ, растет, поэтому родители должны взвесить все за и против естественного и искусственного способов зачатия. И хотя у традиционного внутриутробного зачатия через секс есть свои неоспоримые и неизменные плюсы, в основном для здоровья, а с самим процессом ЭКО также связаны небольшие дополнительные и малоизвестные риски, со временем у скрининга и искусственного оплодотворения, вероятно, будет все больше плюсов.
Подумайте обо всех мерах, на которые идут родители, чтобы защитить детей. Матери пьют витамины для беременных, моют свои и детские руки антисептическими средствами, пристегивают детей ремнями безопасности в машинах, надевают шлемы на велосипедах и кормят их полезной едой.
Хотя риски возникновения опасностей различаются, современные родители почему-то считают, что основная часть их работы заключается в максимальном снижении этих рисков, и часто критикуют людей с иными взглядами. Для примера можно вспомнить реакцию большинства американских родителей на движение антипрививочников.
В 2015 году, когда 147 непривитых детей заболели корью после посещения «Диснейленда», их родителей массово осуждали за то, что они подвергли опасности сотни других[25]. В спорах антипрививочников часто слышны доводы, насколько «естественно» не прививать детей от инфекционных заболеваний. Тем не менее в то, что их логика верна, поверить сложно.
С тех пор, как в XIX веке в Англии появилась первая вакцина от оспы, вакцинация спасла миллионы жизней. Многочисленные исследования по всему миру доказали безопасность вакцин и их явную пользу для человека и общества[26]. Несмотря на это, необоснованные и иррациональные страхи перед прививками никуда не исчезли. В последние годы такие знаменитости, как Дженни МакКарти, Джим Керри и Дональд Трамп[27], публично жаловались на риски вакцинации (неподтвержденные наукой), из-за чего количество непривитых американских детей с 2001 года увеличилось в четыре раза[28]. Такой же спор между группами родителей об использовании неестественных научных достижений или отказе от них возник и при обсуждении скрининга эмбрионов.
Растущее качество и доступность неинвазивных пренатальных анализов крови позволили родителям получить еще больше информации о генетическом статусе эмбриона внутри матери. Но душевные страдания при решении прервать беременность из-за генетических отклонений, способных привести к серьезным проблемам, могут оказаться еще больнее и бессмысленнее – в сравнении с изначальным отбором предымплантированных эмбрионов на основании статистических вероятностей[29].
Сегодня при ЭКО и ПГТ можно отследить все больше одногенных мутаций, стоимость анализов становится все ниже, безопасность процедур растет, а с нею – и важность скрининга и предымплантационного отбора эмбрионов в лаборатории. Сперва родителям нужно уравновесить свою веру в половое размножение с пользой эмбрионального скрининга. Но еще долгое время это будет неравной битвой. По мере того, как мы научимся избегать все большего количества генетических заболеваний, сторонники традиционных форм зачатия начнут казаться сегодняшними антипрививочниками.
Изменение социальных норм зачатия приведет к тому, что прогрессивные родители начнут воспринимать половое размножение как нечто рискованное. Люди продолжат заниматься сексом по тем же приятным причинам, что и сейчас, но только не для зачатия ребенка. Все больше родителей захотят зачать ребенка вне матери, секвенируя и выбирая эмбрион и, в несколько отдаленном будущем, изменяя его.
Хотя некоторые родители откажутся от этого процесса по идеологическим соображениям или же из-за чрезмерной увлеченности друг другом на заднем сидении автолета, зачатие через секс будет сопряжено с определенными недостатками.
Сколько людей готовы смотреть, как соседский ребенок умирает от предотвратимого генетического заболевания, и не винить в этом родителей? Станут ли они считать таких людей «поборниками естественности» из Диснейленда или идеологами, идущими на неоправданные риски, которые могут навредить их же детям?
Не так давно в Исландии провели контрольный тест, который должен был показать, как далеко готовы зайти родители в попытках предотвратить генетические аномалии у своих потомков.
* * *
Дети с синдромом Дауна рождаются с дополнительной копией 21-й хромосомы, которая приводит к пороку сердца, нарушению развития и когнитивных функций, увеличивает риск онкологии и смертности. Тем не менее многие дети вырастают счастливыми и социально развитыми людьми, которые приносят существенный вклад в жизни людей вокруг и общества в целом. Многие люди, чьи дети, братья и сестры, супруги и друзья больны синдромом Дауна, считают их божьим благословением.
Начиная с 2000-х годов исландские врачи должны были информировать будущих матерей о существовании скрининговых тестов, которые оплачивались государственной системой здравоохранения и могли с высокой долей вероятности определить, будут ли у ребенка синдром Дауна или другие генетические заболевания. На протяжении 10 лет подобных тестов почти все женщины, получившие положительный результат на синдром Дауна, решали прервать беременность[30]. Схожий коэффициент прерывания беременности при наличии синдрома Дауна у эмбрионов отметился и в других странах. Австралия, Китай, Дания и Великобритания – везде коэффициент доходит до 90–98 %[31].
Среди других развитых стран выделяются Соединенные Штаты со своими непрекращающимися религиозными дебатами на тему абортов. Опрос 2007 года показал: лишь 20 % американцев считают, что родители должны иметь право на прерывание беременности в случае, если плод «имеет серьезные, но не смертельные генетические отклонения или заболевания, например синдром Дауна»[32]. Однако после диагностирования синдрома Дауна 67 % американцев выбирали аборт[33]. Эти противоречивые данные показывают, как тяжело даются такие решения.[34]
Критики масштабного скрининга и прерывания беременности из-за синдрома Дауна поднимают несколько серьезных вопросов. Кто сказал, что жизнь человека с синдромом Дауна имеет меньшую ценность? Какими моральными критериями мы можем руководствоваться в таких ситуациях? Эти глубоко личные вопросы обращены к истокам нашей человечности. Но в мире, где ЭКО и предымплантационный отбор эмбрионов стали нормой, потенциальные родители не обязательно будут задаваться экзистенциальными вопросами. Если большинство матерей и родителей в развитых странах уже принимают тяжелейшие решения о прерывании беременности из-за синдрома Дауна или других генетических отклонений, то представьте себе, что случится, когда проблему начнут решать выбором 1 из 15 ранних эмбрионов на стекле для имплантации. Каждый из таких ранних эмбрионов будет «естественным» ребенком, но выносить можно будет только одного или двух.
Врачи, выполняющие ЭКО в центрах планирования семьи, давно отбирают эмбрионы с меньшей вероятностью выкидыша. Неужели мы всерьез ждем, что будущая мать засомневается, какой неимплантированный эмбрион выбрать, зная, что какие-то из них могут унаследовать тяжело протекающее заболевание, значительно сокращающее жизнь? Захотим ли мы, чтобы родителей законодательно обязали имплантировать эмбриона, который вырастет в ребенка с синдромом Дауна или получит смертный приговор в виде болезни Гентингтона или Тея – Сакса?
Когда я писал эту книгу, я опубликовал в Facebook опрос: согласятся ли мои друзья подкорректировать предымплантированные эмбрионы, чтобы наделить будущих детей дополнительными чертами и способностями? Моя давняя подруга написала следующее:
«Для меня как матери ребенка с синдромом Дауна такой вопрос – это сложная дилемма. Будь у меня выбор, я уверена, что предпочла бы, чтобы [мой сын] НЕ имел СД [синдром Дауна]. Но поставленный диагноз принес в нашу семью так много радости. У нас есть «вторая семья», всегда готовая помочь. И он учит меня чему-то новому каждый день. Мой сын – один из самых веселых и радостных пятилеток из всех, что я знаю. С другой стороны, если бы я могла предотвратить мучения, которые он уже испытывает и с которыми будет жить дальше, то, думаю, захотела бы это изменить. Каждый родитель желает своему ребенку счастья и успехов в достижении того, что приносит ему счастье».
Говоря, что родители предпочтут не имплантировать эмбрионы с синдромом Дауна, мы не подразумеваем, что жизни рожденных детей с подобными аномалиями менее ценны. Но поскольку родители по всему миру уже и так принимают куда более сложные решения о прерывании беременности, узнав о генетических аномалиях, вполне разумно, что они захотят провериться на генетические заболевания еще до наступления беременности. Отбор предымплантированных эмбрионов в лаборатории будет менее жестоким, чем решение об аборте.
Государства и страховые компании – как минимум те, которые подчиняются рационным системам здравоохранения и в которых споры об этичности абортов исключены, – будут активнее побуждать людей проходить ЭКО и предымплантационный скрининг. Это позволит компаниям избавиться от пожизненных выплат на лечение болезней, которые можно было бы избежать. Чтобы это доказать, достаточно самых простых математических расчетов.[35]
Малыши, рожденные с ранними признаками генетических заболеваний, проводят около трех недель в отделении реанимации для новорожденных, что обходится в среднем в 3000 долларов в день, или 60 000 долларов за ребенка. Затем затраты на медицинское лечение стремительно растут[36]. В среднем дополнительные затраты на лечение муковисцидоза в США составляют 15 571 доллар в год. Средняя продолжительность жизни больного муковисцидозом составляет 37 лет. В итоге пожизненные затраты на лечение доходят до 600 000 долларов. С учетом того, что в США больных муковисцидозом около 30 000, общая сумма расходов на лечение составляет около 467 миллионов долларов[37].
Такая же модель вычислений показывает, что от 100 до 150 миллионов долларов уходит на пожизненную оплату лечения для 30 000 американцев с болезнью Гентингтона и 850 миллионов долларов идет на лечение как минимум 200 000 человек с синдромом Дауна[38][39]. Все эти суммы являются обязательными инвестициями в дорогих кому-то людей, ведь каждый из них заслуживает возможности раскрыть свой потенциал и наслаждаться жизнью. Поэтому никакая цена не может быть слишком высокой, если речь идет об уменьшении страданий хотя бы одного человека.
Но каждый день нам приходится делать трудный выбор. Если бы Америка направила весь свой ВВП на лечение или исследование определенной болезни, то, скорее всего, мы бы смогли существенно расширить свои возможности. Но мы вкладываем столько средств не из-за безразличия к какому-то заболеванию, а потому что обществу нужен баланс различных и значимых интересов для правильного функционирования. Предымплантационный скрининг эмбрионов будет доступен всем, когда социальные преимущества перевесят финансовые и прочие расходы.
Если бы скрининг всех эмбрионов в США на спектр генетических заболеваний обходился бы на 1 доллар дешевле, чем суммарные затраты на лечение всех людей, рожденных с таким заболеванием, то общество выиграло бы экономически и одновременно снизило бы уровень боли и страданий. Если разделить суммарную ежегодную стоимость лечения этих болезней на общее количество детей, рождающихся в США каждый год, мы получим примерную стоимость, за которую каждый будущий родитель мог бы получить ЭКО и предымплантационный скрининг эмбрионов без дополнительной финансовой нагрузки на общество. Эту точку зрения легко доказать простыми подсчетами на коленке.
Каждый год в США рождается около 4 миллионов детей. Предположим, с генетическими заболеваниями рождается 2 %, то есть 80 000 детей[40]. Если на лечение каждого из них необходимо выделять суммы, равные пожизненным отчислениям при муковисцидозе (по 600 000 долларов), то это означает дополнительные затраты в размере 48 миллиардов долларов в течение следующих 37 лет. Если бы мы выделили обеспечение на скрининг эмбрионов, которым можно было бы воспользоваться уже сейчас, это позволило бы потратить 16 500 долларов на ЭКО и ПГТ для каждой американки, желающей завести ребенка. Включение в расчеты стоимости других генетических и частично генетических заболеваний, которые проявляются в жизни позднее (диабет, болезнь Альцгеймера и некоторые виды рака), значительно увеличит изначальные 16 500 долларов.[41]
ЭКО в США – это чрезвычайно дорогостоящая процедура, которая обычно обходится в 12 000–30 000 долларов за один этап. Поскольку в среднем пары делают три попытки, стоимость процедуры быстро становится чрезвычайно высокой для большинства амерканцев[42]. Но в других странах стоимость ЭКО значительно ниже. Например, в Турции – ЭКО стоит около 8500 долларов, в Англии – 8000 долларов, в Испании – 5600 долларов, в Мексике – 4000 долларов, в Корее – 3000 долларов и в Польше – около 1200 долларов[43]. В Израиле, где ЭКО для женщин моложе 45 лет полностью оплачивает национальная система здравоохранения, общий показатель ЭКО по стране растет двухзначными числами; процент успешности процедуры высокий, а стоимость для пациентов из-за рубежа – низкая[44].
Если стоимость ЭКО и отбора эмбрионов в США остается высокой, то родители даже с небольшим бюджетом смогут получить услугу в другой стране. Как только ЭКО и эмбриональный скрининг станут нормой, будущие родители по всему миру начнут требовать добавить эти процедуры в список услуг, покрываемых медицинской страховкой, конкуренция между центрами ЭКО снизит цены, а доступность, качество и наше понимание генетики предымплантированных эмбрионов начнут расти[45]. Потребители, медицинские учреждения, страховые компании и государственные плательщики будут стремиться к общей цели.
Дальновидные работодатели уже подхватили эту волну. В 2014 году Apple и Facebook объявили, что собираются оплатить стоимость заморозки яйцеклеток своих сотрудниц. Многие известные женщины охарактеризовали это решение как уловку, призванную обмануть женщин, заставив их отложить материнство и продолжить работу[46]. Однако подавляющее большинство, включая Шерил Сэндберг из Facebook, увидело в этом неизбежный шаг вперед, дающий женщинам больше репродуктивных возможностей[47]. С тех пор многие компании, включая Amazon, Google, Intel, Microsoft, Spotify и Wayfair, пошли по тому же пути. Не так давно такие компании, как Starbucks, Facebook, Uber и NewsCorp, включили ЭКО в медицинскую страховку своих сотрудников. Согласно опросу от FertilityIQ, женщины, работающие на компании, которые включают ЭКО в страховку, более лояльны к своему работодателю[48]. Если много сотрудников потребует включить ЭКО в медицинскую страховку, то самые лучшие и конкурентоспособные работодатели это реализуют.
На стыке недорогого и массового секвенирования генома, ЭКО, отбора эмбрионов и изменения культурных устоев, а также финансовых моделей мы подойдем к пересмотру сегодняшних и будущих способов зачатия. То, чем мы занимались на заднем сидении, отойдет на второй план, поскольку при зачатии ребенка через секс родители лишатся преимуществ генетического отбора. Переход от естественного зачатия был бы весьма вероятен, если бы наше понимание генома развивалось только линейно. Однако в свете экспоненциального роста нашего понимания устройства и проявления генов, такой переход неизбежен[49].


