Дмитрий Михайлович Евдокимов
Герпетический кератит: от симптомов до выздоровления
Дизайнер обложки DALL-E 3
© Дмитрий Михайлович Евдокимов, 2025
© DALL-E 3, дизайн обложки, 2025
ISBN 978-5-0065-9680-1
Создано в интеллектуальной издательской системе Ridero
Имеются противопоказания. Требуется консультация специалиста
Введение: Значимость проблемы герпетического кератита
Герпетический кератит (Herpes Simplex Virus keratitis) остаётся одной из самых значимых причин инфекционной слепоты в мире, несмотря на достижения современной медицины. Его рецидивирующий характер, сложная диагностика и необходимость в длительном лечении делают заболевание важной темой для врачей-офтальмологов.
1. Герпетический кератит как основная причина инфекционной слепоты
Герпетический кератит (ГК) занимает лидирующую позицию среди инфекционных причин потери зрения, опережая бактериальные, грибковые и паразитарные кератиты.
Механизм слепоты:
Основные процессы, приводящие к ухудшению зрения, включают:
– Повреждение эпителия и стромы роговицы с формированием необратимых рубцов.
– Хроническое воспаление, вызывающее неоваскуляризацию роговицы.
– Развитие вторичных осложнений, таких как глаукома или синдром сухого глаза.
Статистика:
– По данным ВОЗ, герпетический кератит ежегодно поражает более 1,5 миллионов человек по всему миру, из которых около 40 тысяч теряют зрение на один или оба глаза. Смотри источник 1 в приложении.
– В 25% случаев это заболевание становится причиной кератопластики.
2. Эпидемиология: глобальная распространённость и группы риска
Глобальная распространённость герпетического кератита варьируется в зависимости от региона, уровня здравоохранения и климатических условий.
Общие показатели:
– Распространённость инфекции HSV-1 среди населения составляет до 90% в некоторых регионах, что создаёт высокую вероятность возникновения офтальмологической формы заболевания.
– Частота рецидивов: более 25% пациентов, перенёсших первый эпизод ГК, страдают рецидивами в течение первого года, а у 50% пациентов рецидив возникает в течение 5 лет. Смотри источник 2 в приложении.
Группы риска:
– Пациенты с иммунодефицитными состояниями (например, ВИЧ-инфекция, длительная иммуносупрессивная терапия, трансплантация органов).
– Лица пожилого возраста, у которых снижены регенераторные способности тканей роговицы.
– Дети и молодые люди, у которых высок риск первичного инфицирования.
– Жители регионов с высоким уровнем ультрафиолетового излучения, так как UV-облучение активирует вирус. Смотри источник 3 в приложении.
Климатический фактор:
В странах с тропическим и субтропическим климатом более высокая частота случаев связана с активацией вируса под воздействием солнца.
3. Экономическое и социальное бремя заболевания
Прямые медицинские затраты:
Лечение герпетического кератита требует значительных ресурсов, включая:
– Длительную терапию противовирусными препаратами и иммуномодуляторами.
– Повторные визиты к врачу для мониторинга.
– Возможное хирургическое вмешательство (например, кератопластику).
– В США, например, ежегодные затраты на лечение герпетических инфекций глаз составляют более $700 миллионов. Смотри источник 4 в приложении.
Непрямые затраты:
– Потеря трудоспособности пациентов, особенно в период рецидивов.
– Пропуски работы и снижение продуктивности из-за необходимости регулярного лечения.
– Социальные издержки, включая психологический стресс, связанный с хроническим характером заболевания.
Качество жизни:
Ухудшение зрения и частые обострения ГК значительно снижают качество жизни пациентов, включая:
– Ограничение повседневной активности.
– Страх потери зрения из-за рецидивов.
– Депрессии и тревожные расстройства, связанные с длительным лечением.
Экономическое бремя герпеса
По данным ВОЗ. 2024:
– Ежегодные экономические потери от герпеса оцениваются в $35 миллиардов.
– Генитальный герпес вызывает значительные расходы на здравоохранение и снижение производительности труда. Смотри источник 5 в приложении.
Итог: Герпетический кератит – это не только медицинская, но и социально-экономическая проблема, требующая междисциплинарного подхода к лечению и профилактике. Её глобальная значимость диктует необходимость разработки новых методов диагностики, терапии и профилактики, которые снизят распространённость заболевания и его тяжёлые последствия.
Краткая характеристика Herpes Simplex Virus (HSV)
Герпесвирус человека (Herpes Simplex Virus, HSV) – это широко распространённый ДНК-содержащий вирус, принадлежащий к семейству Herpesviridae. Его уникальной особенностью является способность к латентной персистенции в организме и реактивации под влиянием внешних и внутренних факторов. В контексте офтальмологии ключевую роль играют два типа вируса: HSV-1 и HSV-2.
1. Типы HSV-1 и HSV-2
HSV-1 и HSV-2 имеют схожую генетическую структуру, но отличаются предпочтительными путями передачи, тканевой тропностью и спектром заболеваний.
HSV-1 (Herpes Simplex Virus Type 1):
Основные клинические проявления:
– Лидер среди причин офтальмогерпеса: вызывает эпителиальный, стромальный и эндотелиальный кератиты, кератоувеиты и рецидивирующие поражения век (герпетический блефарит).
– Также ассоциирован с оральным герпесом и энцефалитом.
Пути передачи:
– Контактный: через слюну, кожные покровы, слизистые оболочки.
– Возможен перенос на роговицу через контаминированные руки или предметы (например, контактные линзы).
Эпидемиологическая значимость:
– Более 60% взрослого населения мира инфицированы HSV-1.
– Преобладает в странах с умеренным и холодным климатом.
HSV-2 (Herpes Simplex Virus Type 2):
Основные клинические проявления:
– Чаще вызывает генитальный герпес, но при неонатальном герпесе может поражать глаза (например, кератоконъюнктивит).
– Реже вовлекается в офтальмологическую патологию у взрослых.
Пути передачи:
– Половой: основная форма распространения среди взрослых.
– Вертикальный: от матери к новорождённому при прохождении через родовые пути.
Эпидемиологическая значимость:
– Встречается у 10—20% населения в зависимости от региона, чаще в странах с высокой распространённостью ВИЧ-инфекции. Смотри источник 6 в приложении.
Сравнение типов:
HSV-1 более тропен к нервным ганглиям тройничного нерва и глазной области, в то время как HSV-2 в основном поражает сакральные ганглии. Тем не менее, оба типа способны поражать как глаза, так и другие органы.
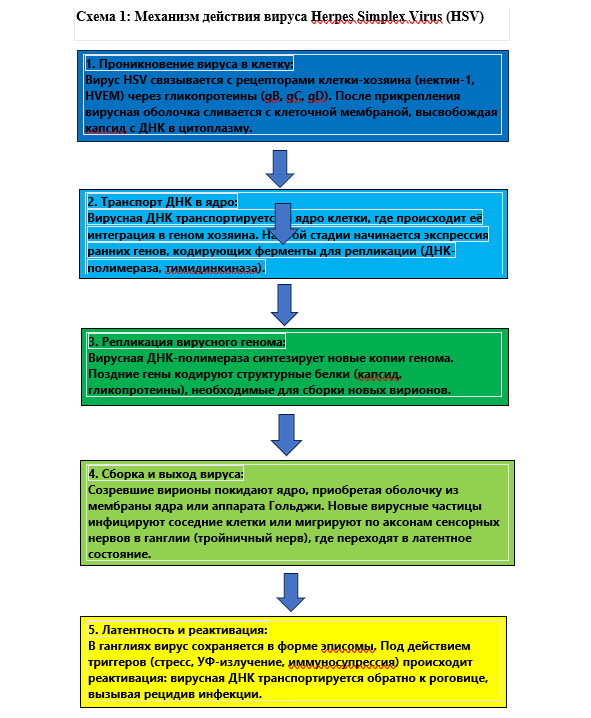
2. Механизмы инфекционности и персистенции вируса
Одной из ключевых особенностей HSV является его способность к пожизненной персистенции и периодической реактивации. Эти свойства объясняются уникальными механизмами взаимодействия вируса с клетками хозяина и иммунной системой.
Этапы инфекционного цикла:
– Проникновение в эпителий:
– HSV связывается с рецепторами на поверхности эпителиальных клеток, включая гепарансульфат-протеогликаны (HSPG) и белок нектина-1.
– Вирусный капсид доставляется в ядро клетки, где высвобождается вирусная ДНК.
– Репликация и сборка вирусных частиц:
– Геном вируса реплицируется с использованием ферментов клетки-хозяина.
– Синтезируются ранние и поздние вирусные белки, необходимые для сборки новых вирионов.
– Цитотоксический эффект:
– Лизис клетки-хозяина приводит к воспалению и локальному разрушению ткани, например, эпителия роговицы.
Механизмы персистенции:
После первичной инфекции вирус мигрирует через сенсорные нервы в нейрональные ганглии, где он может сохраняться в латентной форме:
В латентной фазе:
– Вирусная ДНК сохраняется в ядре нейронов в виде эписомы (кольцевой формы, не интегрированной в ДНК хозяина).
– Синтез вирусных белков минимален, что делает вирус «невидимым» для иммунной системы.
При реактивации:
– Под действием триггеров (например, ультрафиолетового излучения, стресса, иммуносупрессии) вирус начинает активную репликацию и миграцию обратно по нервным путям к месту первичного инфицирования.
3. Зона латентности вируса в тройничном нерве
Тройничный нерв (n. trigeminus) – это ключевая структура, где HSV-1 сохраняется в латентной форме.
Расположение:
– Гассеров узел (ganglion trigeminale) служит основным резервуаром вируса. Здесь вирус пребывает в покое между рецидивами.
Механизм латентности:
– Генетическая активность вируса минимальна благодаря эпигенетическому контролю.
– Latency Associated Transcripts (LAT-RNA), некодирующие РНК, играют важную роль в подавлении вирусной репликации и поддержании нейрональной жизнеспособности.
Активация вируса:
– Под воздействием триггеров снижается эпигенетический контроль, вирус реплицируется и мигрирует обратно к роговице.
– Повторные активации приводят к хронизации воспаления и необратимому повреждению роговицы.
4. Современные аспекты изучения HSV
Современные исследования направлены на изучение латентной фазы HSV, предотвращение реактивации и снижение повреждений, вызванных воспалением:
Молекулярные ингибиторы:
Новые препараты, направленные на ингибирование специфических белков вируса, участвующих в активации.
Технологии редактирования генома:
Использование CRISPR/Cas9 для разрушения вирусного генома на стадии латентности.
Иммунные подходы:
Исследуются вакцины, способные стимулировать долговременный клеточный иммунитет против HSV.
Заключение: HSV – это уникальный патоген, который сочетает высокую инфекционность, способность к латентной персистенции и рецидивирующую природу. Для офтальмологов понимание механизмов инфекции, латентности и реактивации является ключом к выбору оптимальной стратегии лечения и профилактики герпетического кератита.
Особенности механизм действия вируса простого герпеса в организме человека представлены на схеме 1.
Глава 1: Этиология и патогенез герпетического кератита
Герпетический кератит (ГК) – одно из наиболее распространённых и тяжёлых инфекционных заболеваний роговицы, вызванное вирусом простого герпеса (Herpes Simplex Virus, HSV). Он развивается как результат сложного взаимодействия между вирусом, эпителием роговицы, иммунной системой хозяина и латентными резервуарами инфекции. Понимание этиологии и патогенеза ГК важно для диагностики, терапии и профилактики его осложнений.
Механизмы заражения HSV
1. Пути передачи
Вирус простого герпеса передаётся контактным путём через слизистые оболочки или повреждённую кожу. Пути заражения зависят от типа вируса (HSV-1 или HSV-2) и возраста пациента:
Контактно-бытовой путь (основной для HSV-1):
– Инфицирование происходит через прямой контакт с поражённой кожей, слизистыми оболочками или слюной инфицированного человека.
– Автоинокуляция возможна при переносе вируса с губ, носа или других зон на глаз через руки, полотенца, контактные линзы или косметику.
Половой путь (характерный для HSV-2):
– Вирус передаётся половым путём, что реже вызывает офтальмогерпес, но может привести к неонатальным инфекциям.
Вертикальная передача:
– HSV-2 передаётся от матери к ребёнку в процессе родов. У новорождённых герпетический кератит часто сопровождается генерализованным поражением.
Редкие пути:
– Аэрозольный (возможен в лабораторных или медицинских условиях).
– Переливание крови (в исключительных случаях).
2. Первичная инфекция
Первичная инфекция возникает при первом контакте с вирусом.
Проникновение вируса:
– HSV проникает через микротравмы кожи или слизистых оболочек, прикрепляясь к специфическим рецепторам (нектин-1, HVEM) на клеточной поверхности.
– После проникновения вирус высвобождает ДНК в ядро клетки-хозяина, где начинается репликация вирусных частиц.
Клинические особенности:
– У большинства пациентов первичная инфекция протекает субклинически, без выраженных симптомов.
– При офтальмологических проявлениях возможно развитие острого эпителиального кератита или герпетического конъюнктивита.
Иммунный ответ:
– Первичная инфекция стимулирует врождённый иммунитет. Интерфероны I типа (IFN-α, IFN-β) ингибируют вирусную репликацию, а нейтрофилы и макрофаги уничтожают инфицированные клетки.
После острой фазы вирус мигрирует по сенсорным нервным окончаниям в региональные ганглии, где устанавливается латентное состояние.
3. Латентность и реактивация
Латентность HSV – это ключевой механизм, который позволяет вирусу сохраняться в организме пожизненно.
Латентная инфекция:
– Вирусная ДНК сохраняется в ядре нейронов тройничного нерва в форме эписомы, не интегрированной в ДНК клетки.
– Латентность поддерживается экспрессией некодирующих транскриптов (Latency-Associated Transcripts, LAT), которые подавляют репликацию вируса и блокируют апоптоз инфицированных нейронов.
Триггеры реактивации:
Реактивация HSV происходит под воздействием факторов, которые нарушают иммунологический контроль:
– Физические: ультрафиолетовое излучение, травмы глаза, хирургические вмешательства.
– Иммунологические: снижение иммунитета (например, при ВИЧ, химиотерапии), вирусные или бактериальные инфекции.
– Эмоциональные: стресс, переутомление.
– Гормональные: гормональные сдвиги у женщин, менструация.
Патогенез HSV-кератита
1. Инфицирование роговицы (первичная инфекция)
Вирус проникает в клетки эпителия роговицы, вызывая их разрушение:
Репликация вируса:
– В инфицированных клетках вирус использует механизмы хозяина для размножения.
– Новые вирусные частицы высвобождаются, инфицируя соседние клетки.
Клеточные повреждения:
– Цитотоксический эффект вируса приводит к гибели эпителиальных клеток и формированию характерных дендритных язв.
Роль иммунной системы:
– Локальная активация врождённого иммунитета вызывает приток нейтрофилов и выделение провоспалительных цитокинов (IL-1, TNF-α).
– Иммунные механизмы защищают от системного распространения вируса, но могут вызывать дополнительное повреждение тканей.
2. Хроническое воспаление (стромальный кератит)
При реактивации вирус вызывает поражение более глубоких слоёв роговицы:
– Иммунный ответ:
– Реактивация активирует Т-клетки, которые инфильтрируют стромальные слои и запускают продукцию провоспалительных цитокинов (IFN-γ, IL-17).
– Антитела против вирусных антигенов могут вызывать комплемент-зависимое повреждение стромы.
– Неоваскуляризация:
– Хроническое воспаление стимулирует рост сосудов в роговице, что нарушает её прозрачность.
– Рубцевание:
– Фиброз стромы вследствие воспаления приводит к стойкому снижению остроты зрения.
3. Эндотелиальные поражения и кератоувеит
Глубокие слои роговицы и передняя камера вовлекаются в процесс при тяжёлых рецидивах:
– Эндотелиальный кератит:
– Отёк стромы и повреждение эндотелия нарушают гидратацию роговицы.
– Кератоувеит:
– Воспаление передней камеры может сопровождаться повышением внутриглазного давления и развитием вторичной глаукомы.
Современные концепции патогенеза. Смотри источник 7 в приложении.
– Роль генетической предрасположенности:
– Генетические полиморфизмы в генах иммунного ответа, таких как TLR3 и IFNL3, могут увеличивать риск тяжёлого течения герпетического кератита.
– Микробиом роговицы:
– Нарушения в микробиоте глазной поверхности ассоциируются с частыми рецидивами.
– Эпигенетические механизмы:
– Исследования показывают, что эпигенетические изменения в нейронах тройничного нерва могут модулировать латентность и реактивацию HSV.
Заключение:
Этиология и патогенез герпетического кератита охватывают сложные взаимодействия вирусных факторов, иммунного ответа и условий организма. Глубокое понимание этих процессов позволяет разрабатывать новые подходы к лечению и профилактике, минимизируя риск рецидивов и долгосрочных осложнений.
Фазность патогенеза HSV-кератита
Герпетический кератит представляет собой поэтапное патологическое состояние, вызванное особенностями жизненного цикла вируса простого герпеса (HSV) и реакции иммунной системы. Патогенез заболевания делится на три ключевые фазы: латентная инфекция, реактивация и повреждение тканей. Каждая из них обусловлена сложным взаимодействием вирусных факторов и защитных механизмов организма.
1. Латентная инфекция
После первичного инфицирования вирус HSV перемещается по сенсорным нервам к регионарным ганглиям, где переходит в состояние латентности.
А) Процесс перехода к латентности:
Миграция вируса в ганглии:
– После заражения роговицы вирус транспортируется через аксональный ток в сенсорные нейроны, преимущественно в тройничный нерв (ganglion trigeminale).
– Здесь вирусная ДНК остается в виде эписомы, не интегрируясь в геном клетки-хозяина.
Механизмы латентности:
– В латентной фазе экспрессируются только определённые некодирующие РНК – транскрипты, ассоциированные с латентностью (Latency-Associated Transcripts, LAT). Эти транскрипты:
– Подавляют вирусную репликацию.
– Блокируют апоптоз инфицированных нейронов.
– Снижают иммунную активность в области ганглия.
– Важным компонентом латентности являются эпигенетические изменения в вирусной ДНК, которые регулируют её транскрипцию.
Б) Иммунный контроль латентной инфекции:
– Латентная инфекция поддерживается иммунным контролем со стороны CD8+ Т-клеток, которые сохраняются в ганглиях.
– Эффекторные цитокины (например, IFN-γ) создают микросреду, препятствующую реактивации вируса.
2. Реактивация: триггеры и механизмы
В состоянии латентности вирус может реактивироваться, переходя к активной репликации и миграции обратно в ткани роговицы.
А) Основные триггеры реактивации:
– Стресс:
– Эмоциональное или физическое перенапряжение активирует гипоталамо-гипофизарно-надпочечниковую ось, приводя к выделению глюкокортикоидов.
– Гормоны стресса ослабляют иммунный контроль и увеличивают вероятность реактивации вируса.
– Ультрафиолетовое излучение (UV):
– УФ-лучи индуцируют локальное воспаление и повреждение тканей.
– Увеличивается выработка провоспалительных цитокинов, таких как IL-1 и IL-6, что снижает активность иммунных клеток, контролирующих вирус.
– УФ-излучение также активирует MAPK-сигнальные пути, которые способствуют вирусной репликации.
– Снижение иммунитета:
– Иммунодефицитные состояния (например, при ВИЧ, злокачественных новообразованиях, химиотерапии) ослабляют клеточный иммунитет, что создаёт условия для выхода вируса из латентного состояния.
– Приём системных кортикостероидов или других иммуносупрессоров также значительно увеличивает риск реактивации.
Б) Механизм реактивации:
– Реактивация инициируется подавлением иммунного контроля в ганглиях, что приводит к активации вирусной репликации.
– Активный вирус мигрирует обратно по сенсорным окончаниям нерва к роговице, вызывая повреждения тканей.
3. Повреждение тканей: вирус и иммунный ответ
Разрушение тканей роговицы при HSV-кератите обусловлено двумя основными механизмами: прямым цитотоксическим действием вируса и опосредованным иммунным ответом.
А) Цитотоксическое действие вируса:
– Разрушение клеток эпителия:
– HSV реплицируется в клетках эпителия роговицы, вызывая их гибель через некроз и апоптоз.
– Дендритные и географические язвы формируются в результате фокальной дегенерации эпителия.
– Действие вирусных белков:
– Вирус кодирует белки, подавляющие иммунные ответы, такие как ICP47, который ингибирует презентацию антигена на MHC-I.
– Белки US3 и UL41 защищают инфицированные клетки от апоптоза, продлевая их использование для репликации вируса.
Б) Иммунный ответ как источник повреждений:
– Роль врождённого иммунитета:
– Нейтрофилы и макрофаги, привлекаемые к месту инфекции, выделяют реактивные формы кислорода и провоспалительные цитокины (IL-1, TNF-α).
– Это усиливает воспаление, но также вызывает повреждение окружающих тканей.
– Адаптивный иммунный ответ:
– CD4+ и CD8+ Т-лимфоциты инфильтрируют стромальные слои роговицы, провоцируя хроническое воспаление.
– Избыточная активность Т-клеток, особенно TH1 и TH17, приводит к продукции интерферона-γ (IFN-γ) и IL-17, что усиливает воспалительную реакцию.
– Фиброз и васкуляризация:
– Хроническое воспаление стимулирует неоваскуляризацию роговицы и образование фиброзной ткани, что нарушает её прозрачность и снижает зрение.
В) Итоговая патология:
– При тяжёлых рецидивах воспаление может распространиться на глубокие структуры глаза (например, переднюю камеру), приводя к развитию кератоувеита, повышению внутриглазного давления и вторичной глаукоме.
Современные концепции повреждений
– Генетическая предрасположенность: Полиморфизмы в генах, таких как IL-1B или IFNL3, ассоциируются с тяжестью воспаления.
– Роль микробиоты: Изменение состава микробиома глазной поверхности влияет на частоту и интенсивность рецидивов.
– Эпигенетика: Эпигенетические модификации вирусной и клеточной ДНК могут определять склонность к реактивации.
Вывод: Фазность патогенеза HSV-кератита подчёркивает важность латентности вируса и триггеров реактивации как ключевых факторов, определяющих рецидивы и тяжесть заболевания. Комбинация прямого цитотоксического действия вируса и чрезмерного иммунного ответа формирует клиническую картину, что требует сбалансированного подхода в терапии.
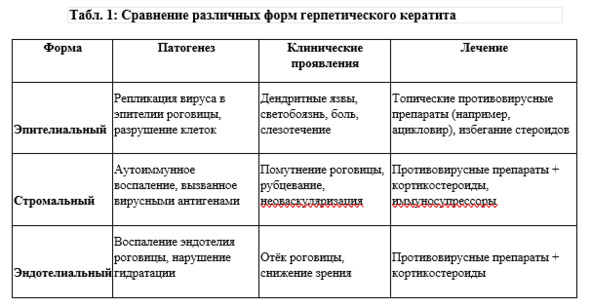
Типы поражения роговицы при герпетическом кератите
Герпетический кератит (ГК) характеризуется широким спектром поражений роговицы, от поверхностного эпителиального до глубокого эндотелиального и стромального. Каждый тип поражения связан с различными патогенетическими механизмами, включающими вирусную репликацию, воспалительные реакции и иммунологическую дисрегуляцию.
1. Эпителиальный кератит: роль вирусной репликации
Эпителиальный кератит является наиболее ранним и распространённым типом поражения роговицы при герпетической инфекции, обусловленным активной репликацией вируса простого герпеса в эпителиальных клетках.
Патогенез:
– Проникновение вируса:
– HSV инфицирует эпителий роговицы, связываясь с клеточными рецепторами, такими как нектин-1 и HVEM (herpesvirus entry mediator).
– После проникновения вирусная ДНК высвобождается в ядро клетки-хозяина, где начинается её активная репликация.
– Разрушение клеток:
– Репликация вируса приводит к накоплению вирусных частиц внутри клеток и их последующему лизису.
– Формируются характерные древовидные или географические язвы, видимые при флуоресцеиновом тесте.
– Воспалительный ответ:
– Врождённый иммунитет активируется, что приводит к выделению интерферонов (IFN-α, IFN-β) и привлекает нейтрофилы.
– Локальная воспалительная реакция ограничивает вирусную репликацию, но может вызывать дополнительное повреждение клеток.
Клинические проявления:
– Типичные симптомы включают боль, светобоязнь, ощущение инородного тела, слезотечение и снижение зрения.
– На биомикроскопии выявляются ветвистые дендритные поражения с буллезными краями, заполненными вирусными частицами.
Особенности лечения:
– Основной подход – противовирусная терапия (например, топические препараты ацикловира или ганцикловира).
– Избегание использования кортикостероидов на этом этапе важно, так как они могут усилить вирусную репликацию.
2. Стромальный кератит: аутоиммунные реакции и фиброз
Стромальный кератит возникает при поражении более глубоких слоёв роговицы, часто в результате реактивации вируса или аутоиммунной дисрегуляции. Это наиболее разрушительная форма ГК, способная привести к необратимым структурным изменениям роговицы.
Патогенез:
– Инициация воспаления:
– Стромальный кератит не всегда связан с активной репликацией вируса; в основе лежат иммунные механизмы, инициированные вирусными антигенами.
– Экспрессия вирусных белков в клетках стромы провоцирует воспалительную реакцию, привлекая Т-клетки и макрофаги.
– Аутоиммунный компонент:
– Реактивные Т-клетки (особенно TH1 и TH17) атакуют стромальные ткани, принимая их за чужеродные.
– Выделение цитокинов, таких как IFN-γ и IL-17, усиливает воспаление и вызывает деградацию внеклеточного матрикса.
– Фиброз:
– Хроническое воспаление стимулирует фибробласты к избыточной продукции коллагена, что приводит к формированию рубцовой ткани.
– Неоваскуляризация роговицы, вызванная воспалением, нарушает её прозрачность.
Клинические проявления:
– Пациенты жалуются на прогрессивное снижение остроты зрения, светобоязнь и боль.
– При биомикроскопии обнаруживается стромальный отёк, инфильтраты и рубцевание.
Особенности лечения:
– Комбинированная терапия противовирусными средствами и топическими кортикостероидами (для контроля воспаления).
– Иммуносупрессоры, такие как циклоспорин, могут быть использованы при тяжёлых формах.
3. Эндотелиальный кератит: дисфункция эндотелия
Эндотелиальный кератит (дисковидный кератит) представляет собой глубокую форму поражения роговицы, характеризующуюся воспалением эндотелия и стромы, что приводит к выраженному нарушению её прозрачности.
Патогенез:
– Реактивация вируса в эндотелии:
– Вирусные антигены или частицы активируют локальный воспалительный процесс в эндотелиальных клетках.
– Прямая вирусная инфекция эндотелия встречается реже; чаще повреждение вызывается иммунным ответом.
– Иммунное воспаление:
– Циркулирующие Т-клетки и моноциты инфильтрируют эндотелий, провоцируя его дисфункцию.
– Выделение провоспалительных цитокинов (например, TNF-α, IL-6) приводит к отёку роговицы и стромы.
– Дисфункция эндотелия:
– Эндотелий теряет способность эффективно регулировать гидратацию роговицы.
– Развивается выраженный стромальный отёк, что существенно снижает прозрачность роговицы и остроту зрения.
Клинические проявления:
– У пациентов отмечаются жалобы на быстрое ухудшение зрения, связанное с отёком роговицы.
– При биомикроскопии наблюдается дисковидный отёк и преципитаты на эндотелии.
Особенности лечения:
– Противовирусные препараты в комбинации с кортикостероидами используются для контроля воспаления.
– В случаях рефрактерного отёка может потребоваться терапия гиперосмотическими средствами (например, растворами хлорида натрия).
Общие замечания по типам поражений
– Переход между формами: Поражения роговицы могут прогрессировать от эпителиального к стромальному и эндотелиальному кератиту, что требует своевременного вмешательства.
– Хронические изменения: Стромальный фиброз и васкуляризация необратимы, что подчёркивает важность ранней диагностики и лечения.
– Иммуномодуляция: Современные подходы к лечению включают иммунотерапию, направленную на снижение аутоиммунного повреждения без ослабления противовирусной защиты.
Особенности патогенеза, клинических проявлений и лечения различных форм герпетического кератита представлены в табл. 1.
Вывод: Типы поражений роговицы при герпетическом кератите демонстрируют сложное взаимодействие вирусных и иммунных факторов. Эффективное лечение требует индивидуального подхода, основанного на стадии заболевания и преобладающем патогенетическом механизме.