
Екатерина Умнякова
Как работает иммунитет
Клетка бактерии устроена проще, но вовсе не «примитивнее», чем клетка животного происхождения. Бактериальная клетка обладает всеми признаками живой системы. По сути, это самостоятельный организм. В отличие от клеток животных, у бактерий нет оформленного клеточного ядра, а ДНК находится в цитоплазме. Отсутствуют и эндоплазматическая сеть, и аппарат Гольджи, и митохондрии – бактерии «дышат» с помощью своей цитоплазматической мембраны и лизосом. В отличие от животных клеток, у бактерий упрощены системы транспортировки и хранения веществ. Возможно одной из причин количественного преобладания бактерий на Земле является наличие у них особенной защитной структуры – клеточной стенки, которая представляет из себя плотную оболочку из пептидогликана над цитоплазматической мембраной. Она защищает бактерию от неблагоприятных условий. В клетках животных клеточная стенка отсутствует.
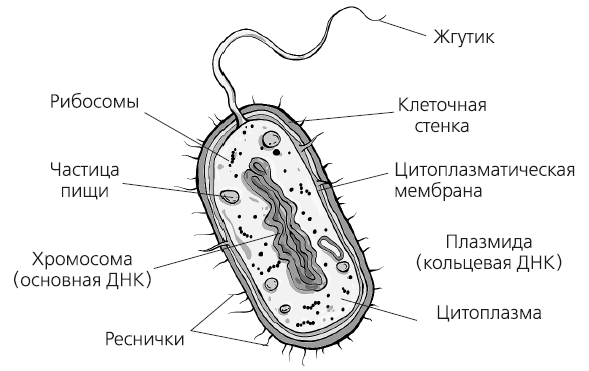
Строение бактериальной клетки
Существует несколько видов клеток врожденного иммунитета человека – это базофилы, эозинофилы, натуральные киллеры, нейтрофилы, моноциты и их формы, мигрировавшие из кровотока в ткани – макрофаги. Последние два типа клеток иммунной системы известны также как фагоциты – клетки, способные к фагоцитозу, то есть к поглощению различных вредоносных организмов. Процесс захвата и переваривания частиц внутри клетки был впервые описан в 1875 году канадским врачом Уильямом Ослером. В своей работе «Патологии легких шахтеров» он рассказал о процессе накопления угольных частичек в клетках легких работников шахт. Однако то, что это явление имеет отношение к механизмам защиты организма, впервые предложил русский ученый, «отец» отечественной иммунологии Илья Мечников. Его фундаментальные труды по фагоцитарной теории иммунитета о том, что иммунные клетки способны поедать и переваривать чужеродные организмы, были признаны мировым сообществом. В своих работах 1883 года Мечников впервые систематизировал факты, предложив учение об иммунитете. В 1908 году Илья Мечников был удостоен Нобелевской премии по физиологии и медицине «за труды в области иммунитета». Он получил эту награду совместно с другим великим ученым немецкого происхождения Паулем Эрлихом. Этому исследователю принадлежит идея о «магической пуле», которая могла бы прицельно убивать бактериальные клетки. Эрлих первым получил сальварсан или арсфенамин – «препарат номер 606», которым относительно успешно лечили сифилис. Кроме того, Пауль Эрлих первым описал разные типы иммунных клеток. Он использовал в своих экспериментах «кислые», разработанные им «нейтральные» и «оснóвные» анилиновые красители. Благодаря применению усовершенствованных методов окрашивания белых кровяных телец и сопоставлению их с морфологическими свойствами различных клеток, Пауль Эрлих смог отделить несколько лейкоцитарных подмножеств друг от друга. Результаты его работы отражены в названиях клеток врожденного иммунитета: нейтрофил – лейкоцит, окрашивающийся «нейтральным» красителем; базофил – лейкоцит, окрашивающийся «оснóвным» красителем (от латинского «basis» – основание); эозинофил – лейкоцит, окрашивающийся «кислым» красителем эозином (от греческого («эос») – «утренняя заря»).
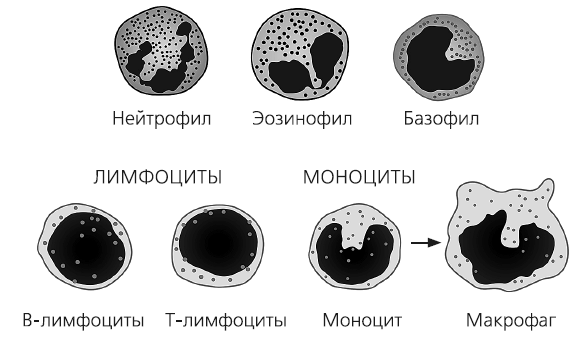
Клетки иммунитета.
Несмотря на различия клеток врожденного иммунитета, о которых речь пойдет позднее, все клетки врожденного иммунитета являются потомками стволовых клеток крови и представителями белых кровяных телец – лейкоцитов. У каждой такой иммунной клетки есть своя специализация. И, тем не менее, их объединяют несколько задач. Наиболее важные – это защита организма от потенциально опасных существ, уборка клеточного и молекулярного «мусора», а также подавление процессов аутовоспаления, при котором происходит нейтрализация неадекватных реакций других иммунных клеток.
В начале книги мы сравнивали защитную систему организма с многоступенчатой системой обороны замка. Метафорически каждый тип иммунных клеток можно сравнить с определенным родом войск.
Нейтрофилы
Нейтрофилы – это «пехотинцы» иммунной системы. Этих иммунных клеток в организме намного больше, чем остальных лейкоцитов – до 50–70 % всей популяции белых кровяных телец. Нейтрофилы быстрее всех попадают в район очага воспаления и переходят к активным действиям. Эти клетки вооружены молекулами иммунитета, которые способны уничтожать патогены. Один из возможных результатов «баталий» нейтрофилов с возбудителями инфекций – возникновение гнойников. Гной – это мертвые нейтрофилы и другие клетки, которые попали в радиус «столкновения» представителей лейкоцитов и возбудителей инфекций. Помимо атак, последствия которых заметны человеческому глазу, нейтрофилы способны поглощать бактериальные клетки и переваривать их без выброса сигнальных молекул. Таким образом другие клетки иммунитета не подключаются к атаке патогенов, и воспаления не возникает. Интересно, что нейтрализация угрозы нейтрофилами «без шума и пыли» происходит гораздо чаще, чем образование условных гнойников. Воспаления организму невыгодны. В тех случаях, когда к нейтрофилам подключаются другие клетки иммунитета и в теле все-таки возникают воспалительные процессы, организму приходится тратить множество ресурсов для того, чтобы нейтрализовать и сам очаг воспаления, и неизбежные негативные последствия его присутствия.

Нейтрофил
Эозинофилы
Эозинофилы можно сравнить с артиллерийскими войсками. В эозинофилах сосредоточены огромные запасы сильнейших цитотоксических веществ, под действием которых клетки патогенов разрушаются. Эти вещества по своей силе воздействия напоминают крупнокалиберное оружие, которым эозинофилы «вооружены до зубов». Именно эозинофилы первыми реагируют на вторжение паразитических червей, которые в несколько тысяч раз крупнее любых иммунных клеток. Благодаря высокому содержанию цитотоксических веществ и численному превосходству, эозинофилы способны избавлять организм от паразитов. Эти клетки врожденного иммунитета также участвуют в борьбе с Mycobacterium tuberculosis – возбудителем туберкулеза. Забрасывая очаги скопления микобактерий «химическими бомбами», эозинофилы не только борются с ними, но и разрушают легочную ткань. К сожалению, это довольно серьезно осложняет течение заболевания.

Эозинофил
Натуральные киллеры
Натуральные киллеры – это «отряд бойцов» иммунной системы, который уничтожает собственные дефектные или поврежденные клетки, представляющие угрозу для организма. Например, раковые или зараженные вирусами клетки.

Натуральный киллер
Натуральные киллеры могут «расстреливать» дефектные клетки при помощи специальных молекул – перфоринов и гранулизинов. Эти «пули» образуют поры в оболочке клеток. Часто такие действия натуральных киллеров становятся смертельными для их мишеней. Кроме того, натуральные киллеры используют другие молекулы для сдерживания потенциальных опасностей. Помимо перфоринов и гранулизинов, это гранзимы, усиливающие разрушительные действия первых двух видов молекул. Функция гранзимов состоит в том, чтобы запустить апоптоз – процесс запрограммированной клеточной гибели. После этого клетки-мишени совершают самоубийство и прекращают свою жизнедеятельность.
Моноциты
Моноциты и макрофаги, а также их модифицированные формы по своим функциям напоминают десантников.

Моноцит
Они находятся в крови до тех пор, пока им не поступает сигнал о попадании инфекции в организм. После этого клеточные подразделения направляются в ткани и органы, пораженные инфекциями, где они становятся тканевыми макрофагами. Там они поглощают возбудителей заболеваний и устраняют последствия деятельности нейтрофилов, эозинофилов и других типов иммунных клеток.
Базофилы
Базофилы в рамках иммунной системы выполняют функции связистов. Эти клетки мобилизуют и привлекают другие типы иммунных клеток, которые борются с инфекциями и иными угрозами. Базофилы обладают множеством сигнальных молекул, с помощью которых они передают информацию другим клеткам иммунной системы.
Клетки приобретенного иммунитета делятся на T- и B-лимфоциты. T- и В-лимфоциты образуются в костном мозге из стволовых клеток крови, как и другие лейкоциты. На поверхности у этих клеток находятся рецепторы – молекулы, несущие «зеркальные отпечатки» определённой части антигенов. Рецепторы присоединяются к одному антигену, сигнализируя тем самым о необходимости запуска иммунного ответа. Одна иммунная клетка может содержать рецепторы только для одного вида антигенов.

Базофил
Несмотря на то, что у Т-лимфоцитов есть рецепторы, они не умеют распознавать антигены, если те не представлены специальным образом. У всех клеток организма на поверхности присутствуют молекулы MHC – главного комплекса гистосовместимости (от англ. major histocompatibility complex). Молекулы МНС служат своего рода индикатором нормальной работы клетки и отсутствия заражений. Если клетка здорова, то МНС продемонстрирует Т-лимфоцитам собственные части белковых молекул, произведенных здоровой клеткой организма. Если же она заражена, то на молекулах MHC появятся чужеродные белковые фрагменты. Они становятся сигналом для Т-лимфоцитов к запуску иммунного ответа.

Лимфоциты
Выделяют 3 типа T-лимфоцитов: T-киллеры (в переводе с английского «to kill» – убивать) уничтожают зараженные клетки, Т-хелперы (от английского «to help» – помогать) сигнализируют другим клеткам о наличии угрозы и помогают бороться с инфекцией, и T-регуляторные клетки, которые контролируют иммунный ответ.
По одной из гипотез, молекулы MHC помогают найти полового партнера для размножения с помощью обонятельных сигналов – феромонов. Феромоны помогают определить вид, пол особи и генетическую совместимость. А гены молекул MHC обеспечивают основу для развития набора уникального «запаха». Чем больше различий в молекулах MHC у двух особей противоположного пола, тем более привлекательными они будут казаться друг другу, потому что это эволюционно выгодно: их генетические различия помогут оставить потомство с уникальным набором генов.
После обнаружения мишеней, Т-киллеры с помощью перфоринов и гранулизинов ликвидируют клетки организма, зараженные вирусами, а также опухолевые клетки.
Т-хелперы регулируют реакции как врождённого, так и приобретённого иммунитета, определяют программу иммунного ответа на конкретный патоген. Существуют два вида Т-хелперов – Т-хелперы первого типа (Th1) и Т-хелперы второго типа (Th2). Т-хелперы первого типа выделяют сигнальные молекулы и направляют макрофаги. Т-киллеры же вместе с макрофагами убивают чужеродные, зараженные или злокачественные клетки. Т-хелперы второго типа сигнализируют о возбудителе инфекции базофилам в слизистых организма для того, чтобы в конечном итоге вызвать воспаление при помощи гистамина. По сути, все T-хелперы связывают два звена иммунитета – врожденный и приобретенный.

T-лимфоцит
T-регуляторные лимфоциты (T-reg) подавляют размножение T-лимфоцитов для того, чтобы регулировать силу иммунного ответа. Эти клетки вырабатывают молекулы, которые фактически являются стоп-сигналами для развития иммунных реакций. T-регуляторные лимфоциты называют также Т-супрессорными клетками, то есть клетками, подавляющими активность Т-киллеров и Т-хелперов.
В отличие от T-клеток, B-клетки не нуждаются в предварительной обработке антигена и в его «представлении» на поверхности клетки, которая его поглотила.
B-лимфоциты распознают чужеродный антиген с помощью рецепторов и вырабатывают против него антитела – специальные молекулы приобретенного иммунитета, которые помечают чужеродные организмы или их части, сигнализируя об опасности. Каждая созревшая в костном мозге линия B-клеток может продуцировать уникальный, только для неё характерный тип антител. Антитела или иммуноглобулины – это белки-наводчики, основная функция которых заключается в том, чтобы определить координаты мишени для ее уничтожения. О том, какими они бывают и как помогают находить иммунным клеткам чужеродные частицы, речь пойдет в следующем разделе. Процесс образования антител идет постоянно, но усиливается после того, как в организм попадает возбудитель инфекций. Кроме антител, В-лимфоциты производят B-клетки памяти, которые обеспечивают быстрый иммунный ответ при повторном попадании в организм того же антигена. В-клетки позволяют иммунной системе «помнить» антиген на протяжении многих лет после его первого попадания в организм.

B-клетка
Дендритные клетки
Дендритные клетки — еще один тип клеток, который связывает врожденный иммунитет и приобретенный. Дендритные клетки с длинными отростками находятся в тканях, которые граничат с окружающей средой – в эпителиях кожи, в воздухоносных путях и во многих других частях тела. Их задача – поймать потенциально опасные чужеродные микроорганизмы, разрушить их и доставить в лимфатическую систему. Оттуда патогены попадают к Т-лимфоцитам, которые продолжают каскад иммунных реакций. Рисунок ниже демонстрирует, как может происходить представление антигена дендритной клеткой Т-лимфоциту.

Дендритная клетка

Представление антигена дендритной клеткой Т-лимфоциту. Во вставке сверху показано взаимодействие T-клеточного рецептора с молекулой молекулы MHC.
Тучные клетки
Тучные клетки – еще один тип иммунных клеток, который в том числе запускает процессы воспаления с помощью гистамина. Это вещество, в частности, вызывает аллергические реакции. Тучные клетки также содержат цитокины – сигнальные молекулы иммунной системы, которые необходимы для специализации разных типов клеток, антимикробные белки и пептиды. Кроме того, на поверхности тучных клеток располагаются разные рецепторы, взаимодействие с которыми приводит к выбросу биологически активных веществ. По большому счету, тучные клетки напоминают передвижные склады с боеприпасами и сигнальным оборудованием для обеспечения иммунных реакций.

Тучная клетка
Молекулы иммунитета
О существовании внутри живых организмов веществ, способных бороться с инфекционными агентами, было известно давно. Об этом свидетельствует старинный русский способ хранения молока, когда в крынку опускали лягушку. Секрет желез кожи этого животного обладает антимикробными свойствами и не позволяет молоку скиснуть.

Лизоцим
В медицине Древнего Китая и Индии для заживления ран и снятия симптомов воспаления также использовали кожу лягушек. Этот же метод вьетнамские хирурги практиковали во время войны в 1960-х, когда не хватало медикаментов и инструментов для лечения ожогов у солдат. Для заживления ран также использовали личинки мух. С древнейших времен было известно о пользе меда и о его целебных свойствах. В наши дни ученые обнаружили, что мед обладает антимикробным действием.
Скорее всего, первой молекулой, для которой была описана антимикробная функция в организме человека, стала молекула белка лизоцима – фермента, разрушающего клеточную стенку бактерий.
Британский микробиолог Александр Флеминг экспериментировал в лаборатории, будучи простуженным. В ходе работы на одну из чашек, в которой росли бактерии, упала капля слизи из его носа. Флеминг заметил, что вскоре из чашки исчезли бактериальные колонии. Это означало, что в носовой слизи ученого содержалось вещество, разрушающее бактериальные клетки. В 1922 Александр Флеминг впервые описал антимикробный эффект лизоцима. Позже он обнаружил лизоцим и в других биологических жидкостях – в слезе, слюне и в материнском молоке. А в 1928 году Александр Флеминг открыл пенициллин – первый антибиотик, который несколько десятков лет успешно использовался в борьбе с бактериальными инфекциями.

Александр Флеминг
Молекулы иммунитета преимущественно имеют белковую природу. Белки (протеины, полипептиды) – это полимеры, состоящие из 20–22 различных аминокислот. Цепочки из аминокислот имеют определенную трехмерную организацию, позволяющую им выполнять различные функции. Помимо иммунной, белки выполняют структурную, двигательную, транспортную, сигнальную, каталитическую, рецепторную и резервную функции.
Белковые молекулы иммунитета не всегда убивают чужеродные микроорганизмы. Исходя из их функций, белковые молекулы иммунитета можно условно разделить на 3 типа: антибиотические белки, которые напрямую убивают патогены; сигнальные, обеспечивающие коммуникацию между различными видами иммунных клеток для эффективного ответа на конкретный тип инфекции; а также опсонины – молекулы-метки, к которым относятся уже упомянутые антитела. Существует также особая система, состоящая из отдельных белков сыворотки крови, которая выполняет все перечисленные выше функции – система комплемента.
Антибиотические молекулы
К антибиотическим молекулам прежде всего относятся те молекулы, которые обладают токсическим действием в отношении патогена. Они могут напрямую поражать бактерии, одноклеточные грибки, и в некоторых случаях вызывать гибель вирусов. Антибиотические молекулы – это своего рода «химическое оружие» организма, которым вооружены клетки иммунитета, а также клетки эпителиев желудочно-кишечного тракта, кожи, воздухоносных и мочеполовых путей.
Лизоцим, например, относится к антибиотическим белкам. Это фермент, который разрушает клеточную стенку бактерий, состоящую из муреина – цепочек полисахаридов, скрепленных пептидными сшивками. Муреин образует нечто вроде защитного слоя над оболочкой клетки бактерии, что создает дополнительный барьер и защищает ее от неблагоприятных воздействий. Этот фермент, содержащийся в слезной и слюнной жидкостях, в грудном молоке и в белковых гранулах нейтрофилов, в печени и в крови, осуществляет антимикробную защиту. Помимо лизоцима, известны и другие белки-ферменты, которые обладают антимикробными свойствами и способны в том числе «переваривать» важные компоненты патогенов. Например, ферменты катепсин G и эластаза, разрушающие белки, а также различные нуклеазы, которые расщепляют ДНК и РНК инфекционных агентов.

Действие миелопероксидазы
Часто белки действуют опосредованно и не являются сами по себе антибиотическими. Например, белок миелопероксидаза, присутствующий в больших количествах в нейтрофилах, производит токсичные для бактерий формы свободных радикалов и окислителей, в том числе – гипохлорит-анион (OCl−). Получается, белок миелопероксидаза опосредованно оказывает бактерицидное действие.
Белок лактоферрин отвечает за транспорт ионов железа в организме. Он содержится в молоке млекопитающих, в слюне, в слезной жидкости, в слизи носоглотки и в других средах организма. Много лактоферрина находится и в нейтрофилах. Благодаря своей способности прочно связывать железо, лактоферрин создает железодефицитную среду там, где могут скапливаться бактерии. Этот белок «отбирает» у них важнейший микроэлемент, без которого бактерии существовать не могут. Лактоферрин также может разрушать мембрану бактериальных клеток. Известно и то, что этот белок, связываясь с вирусными частицами, препятствует проникновению и размножению вирусов внутри клеток. Лактоферрин обладает высокой антигрибковой активностью и рассматривается учеными как перспективный кандидат для разработки нового противогрибкового средства.

Лактоферрин
Кроме довольно громоздких белковых молекул, существуют короткие молекулы белковой природы, обладающие противомикробным действием – антимикробные пептиды. Они состоят из нескольких десятков аминокислот, тогда как белки в своем составе содержат сотни, а иногда и тысячи аминокислотных остатков. Антимикробные пептиды были обнаружены и у бактерий – они получили название «бактериоцины». Микробы используют эти пептидные молекулы для борьбы за существование среди других бактерий, как и некоторые антибиотики. Например, пиоцианин, субтилин, грамицидин С, бацитрацин. Тот микроб, чье «оружие» будет действовать эффективнее «оружия» соперников, получает эволюционное преимущество и колонизирует экологическую нишу, будь то верхние слои почвы или толстый кишечник человека. Антимикробные пептиды были также обнаружены у грибов, простейших, растений и животных – в том числе и у человека. Эти вещества присутствуют у нас в иммунных клетках нейтрофилах, макрофагах, в клетках эпителиев, в крови, в слезной, слюнной жидкости и в грудном молоке.


