
Сергей Ястребов
От атомов к древу: Введение в современную науку о жизни

Научный редактор Александр Марков, д-р биол. наук
Редакторы Валентина Бологова, Наталья Нарциссова
Художественное оформление и макет Андрея Бондаренко
Руководитель проекта Д. Петушкова
Корректоры М. Миловидова, С. Чупахина
Компьютерная верстка А. Фоминов
Оформление обложки и макет Андрей Бондаренко
© С. Ястребов, 2017
© Бондаренко А., художественное оформление, макет, 2018
© ООО “Альпина нон-фикшн”, 2018
Все права защищены. Данная электронная книга предназначена исключительно для частного использования в личных (некоммерческих) целях. Электронная книга, ее части, фрагменты и элементы, включая текст, изображения и иное, не подлежат копированию и любому другому использованию без разрешения правообладателя. В частности, запрещено такое использование, в результате которого электронная книга, ее часть, фрагмент или элемент станут доступными ограниченному или неопределенному кругу лиц, в том числе посредством сети интернет, независимо от того, будет предоставляться доступ за плату или безвозмездно.
Копирование, воспроизведение и иное использование электронной книги, ее частей, фрагментов и элементов, выходящее за пределы частного использования в личных (некоммерческих) целях, без согласия правообладателя является незаконным и влечет уголовную, административную и гражданскую ответственность.

* * *
Посвящается моей матери,
Наталии Борисовне Ястребовой
Предисловие
Как говорил известный биохимик сэр Фредерик Гоулэнд Хопкинс, жизнь – это такая штука, которая происходит (life is a thing that happens){1}. Другими словами, жизнь – это процесс, иногда быстрый, а иногда очень медленный. Пример быстрого жизненного процесса – синтез и распад молекул, снабжающих клетку энергией: время их существования измеряется секундами. Пример медленного процесса – крупные эволюционные изменения, которые иногда растягиваются на миллиарды лет. Область знаний, охватывающая сразу все эти явления, может со стороны показаться необъятной, как пасть древнего бога смерти, одна губа которого достает до неба, а другая – до земли{2}. Отчасти так оно и есть. Биология – очень многоликая наука, к тому же еще и бурно развивающаяся прямо у нас на глазах (чтобы оценить это, достаточно в любой момент просмотреть, например, раздел научных новостей сайта “Элементы”). Неудивительно, что она сейчас многим интересна.
Зададимся следующим вопросом: какую вводную информацию надо сообщить разумному и заинтересованному, но совершенно несведущему в биологии человеку, чтобы он начал более-менее разбираться в этой науке и мог понимать значение свежих биологических открытий?
Предлагаемую книгу можно считать попыткой ответить на этот вопрос. Ее идеальный читатель видится автору как условный “образованный небиолог”, прекрасно (кто может в этом сомневаться?) знающий те науки, которые он серьезно изучал, но не имеющий ровным счетом никакой биологической или химической “базы”. Если такой человек по любой причине заинтересуется биологией, эта книга – для него. Уровня “когда-то что-то учил в школе, но все забыл” для начала вполне хватит.
Конечно, не может быть и речи о том, чтобы рассказать в одной книге сразу про всю современную биологию. Отбор материала – на совести автора, и за пределами совсем уж азбуки он довольно субъективен. Там, где упоминается какая-то спорная или новая информация, стоят ссылки на научные статьи, из которых она взята. Важные термины, которые пригодятся для понимания дальнейшего рассказа, при первом употреблении выделяются курсивом.
Книга состоит из четырех частей: “Химия жизни”, “Механизм жизни”, “Древо жизни” и “История жизни”. В первой части (“Химия жизни”) сообщается, из чего, собственно говоря, состоит живая материя. Вторая часть (“Механизм жизни”) рассказывает о том, как живые существа обращаются с информацией и с энергией. Третья часть (“Древо жизни”) – это обзор всеобщего эволюционного древа. В ней вкратце обсуждается, какие существуют большие группы живых организмов, кто из них кому родня, какие между ними есть важные различия. И наконец, в четвертой части (“История жизни”) вся жизнь на Земле рассматривается как единое целое и мы прослеживаем главные события, произошедшие на нашей планете за последние четыре с лишним миллиарда лет.
Тем, кто соприкоснулся с биологией более или менее впервые, лучше читать эту книгу подряд, по возможности не пропуская глав. Продвинутые читатели, которых в наше время тоже хватает, скорее всего, сориентируются сами. Автор надеется, что некоторые разделы могут быть интересны и профессиональным биологам (это в основном относится ко второй половине книги). И третья, и четвертая части намеренно написаны так, чтобы любую из них можно было читать как самостоятельный очерк. Поэтому, если биологическая “база” у вас есть – вы совершенно спокойно можете читать книгу с середины, а в начало заглянуть потом, если пожелаете.
Когда наброски первой части книги выкладывались в ЖЖ, автору регулярно задавали один и тот же вопрос: почему там так много химии? Ответ: потому что элементная база живых систем – химическая. От этого никуда не денешься. И потом, разве не интересно знать, чем, например, фруктоза, известный компонент диетических сладких продуктов, отличается от обычного сахара, или почему глицин служит успокаивающим средством, или каков механизм действия кофе на нервную систему, или вреден ли на самом деле глутамат? С помощью биологической химии понять такие вещи легко, а без нее совершенно невозможно. В любом случае, об основах химии тут рассказывается с нуля и на таком упрощенном уровне, что автору будет даже неловко перед читателями-химиками, если это сочинение попадет им в руки.
Эпиграфом ко всей книге, наверное, можно было бы поставить знаменитые слова Феодосия Добржанского: “Ничто в биологии не имеет смысла иначе как в свете эволюции” (Nothing in biology makes sense except in the light of evolution){3}. Добржанский, разумеется, был абсолютно прав. Любая особенность любого биологического объекта в конечном счете является результатом какого-нибудь эволюционного – а можно сказать, и “исторического” – события. Надо только выяснить какого. Автору хотелось попытаться применить этот способ объяснения абсолютно ко всем предметам разговора, от атомов и молекул до эволюционного древа (отсюда и название книги). Насколько удачно это получилось, решать читателям.
Несколько слов о том, чего в книге нет. Прежде всего, в ней нет ни одной математической формулы: все изложено на качественном уровне. На первый план выведена классическая событийная история – история живых организмов. Помещенный в начале книги обзор химических основ жизни нужен в основном для того, чтобы лучше понять эту историю (и ее истоки).
Нет и кое-каких разделов, которые традиционно включаются в книги подобного рода и отсутствие которых наверняка заметит критически настроенный читатель. Чтобы облегчить ему задачу, можно уже в предисловии перечислить несколько явных упущений. Во-первых, почти что ни слова не сказано о современной эволюционной теории. Во-вторых, проигнорирована проблема жизненных циклов и их эволюции (даже митоз и мейоз не обсуждаются). В-третьих, разговор про эволюцию планов строения многоклеточных животных заканчивается, не начавшись. Вначале автор хотел посвятить каждой из этих тем по главе, но в ходе работы стало понятно, что это невозможно сделать, если не превращать книгу в многотомник. Все три названные темы – очень интересные, и пробегать их мимоходом не хочется. О них надо рассказывать отдельно.
Благодарности
Великому писателю Умберто Эко – за название. Я решил, что “От атомов к древу” звучит не хуже, чем “От древа к лабиринту”.
Гениальному популяризатору науки Айзеку Азимову – за заочные уроки, которые он щедро рассыпал по своим книгам, и за невероятную жажду знаний, которой он умел заразить читателя.
Памеле Кемп и Карен Армс, авторам замечательной книги “Введение в биологию”, которую я впервые прочитал в 13 лет и которая служит для меня образцом того, как подобные книги надо писать.
Многочисленным читателям научного блога caenogenesis.livejournal.com – за обратную связь, которая была особенно важна в начале работы и которую я получил в полной мере.
Коллективу Летней экологической школы (ЛЭШ) и Весенней экологической школы (ВЭШ), где я читал лекции, послужившие основой для нескольких глав этой книги.
Сотрудникам журнала “Химия и жизнь”, где была предварительно опубликована в виде серии статей четвертая часть книги (“История жизни”). Отдельная благодарность лично Елене Клещенко, работать с которой – огромное удовольствие.
Асе Казанцевой и Денису Земледельцеву – за то, что они взяли на себя труд прочитать черновик и высказать полезные замечания.
Марии Егоровой – за то, что она, будучи по профессии лингвистом, послужила моделью идеального читателя, и за интересные комментарии.
Александру Владимировичу Маркову – за тщательную научную редактуру, в результате которой книга стала лучше, и в целом за поддержку.
Благодарю коллег – высококвалифицированных биологов, согласившихся внимательно прочитать и откомментировать отдельные разделы книги: Михаила Александровича Никитина, Михаила Валерьевича Погорелого, Алексея Викторовича Чернышева, Дмитрия Андреевича Шабанова и особенно Дмитрия Викторовича Леонтьева, который очень помог мне со сложнейшей в научном отношении третьей частью.
И наконец, беспредельная благодарность – моим университетским учителям: Борису Дмитриевичу Васильеву, Феликсу Яновичу Дзержинскому, Александру Сергеевичу Раутиану, Владимиру Васильевичу Малахову, Андрею Александровичу Каменскому, Юрию Таричановичу Дьякову и Леониду Степановичу Гузею. С некоторыми из перечисленных я общался много и тесно, других знал только по лекциям, но повлияли на меня они все. Надеюсь, что в книге это отразилось.
Часть I
Химия жизни
1. Углерод
Мышь любит мармелад, потому что в нем много кислот.
ЮРИЙ ОЛЕША. ТРИ ТОЛСТЯКА
Из чего состоят живые организмы?
Ответить на это очень легко: живые организмы, как и неживые тела, состоят из атомов.
Значение этого утверждения, что называется, трудно переоценить. Нобелевский лауреат Ричард Фейнман говорил в начале своих знаменитых “Фейнмановских лекций по физике”{4}:
“Если бы в результате какой-то мировой катастрофы все накопленные научные знания оказались бы уничтоженными и к грядущим поколениям живых существ перешла бы только одна фраза, то какое утверждение, составленное из наименьшего количества слов, принесло бы наибольшую информацию? Я считаю, что это атомная гипотеза (можете называть еe не гипотезой, а фактом, но это ничего не меняет): все тела состоят из атомов – маленьких телец, которые находятся в беспрерывном движении, притягиваются на небольшом расстоянии, но отталкиваются, если одно из них плотнее прижать в другому”.
Сказанное Фейнманом, конечно, правда. Однако любое научное утверждение обязано иметь те или иные границы применимости. Поищем их и тут. Атомная гипотеза – это великое достижение человеческой мысли, но целиком ли Вселенная состоит из атомов? И все ли живые организмы состоят только из них?
На первый из этих вопросов ответ, как ни странно, будет однозначно отрицательным. Начнем с того, что наша Вселенная возникла в результате Большого взрыва примерно 13,8 миллиарда лет назад, и с тех пор ее состав сильно изменился. Насколько можно судить, в первые 300 000 лет во Вселенной не было ни одного атома (хотя были частицы нескольких других типов). Но и после того, как атомы возникли, они не стали главной составляющей космоса. По данным космической обсерватории “Планк”, нынешняя Вселенная на 4,9 % состоит из обычных элементарных частиц, способных сложиться в атомы, на 26,8 % – из темной материи (которая не проявляет никаких наблюдаемых свойств, кроме массы) и на 68,3 % – из темной энергии (про которую вообще непонятно, связана ли она хоть с какими-нибудь материальными телами){5}. Грубо говоря, Вселенная состоит из обычных атомов не больше чем на 5 %.
Подчеркнем, что эти соотношения отражают современное положение вещей. Несколько миллиардов лет назад они наверняка были иными, ведь Вселенная непрерывно развивается; это подтверждается и расчетами на основе общей теории относительности, и прямыми наблюдениями космического реликтового излучения. Итак, данные исследований показывают, что сейчас части Вселенной, построенные из обычного вещества, представляют собой, по сути, всего лишь острова среди океанов темной материи и темной энергии, в глубины которых людям еще только предстоит заглянуть. (Между прочим, именно о таких исследованиях мечтает доктор Хаус в первой серии восьмого сезона знаменитого сериала.)
А вот на наш второй вопрос – все ли живые системы состоят из атомов? – ответом будет уверенное “да”. В этом плане биологический мир гораздо менее разнообразен, чем физический. Любое живое существо построено из атомов, и только из атомов, в полном соответствии с классической атомной гипотезой. Примеры иных, не атомных форм жизни можно пока найти лишь в научной фантастике. Например, в великом романе Станислава Лема “Солярис” упоминаются живые существа, созданные не из атомов, а из очень легких элементарных частиц – нейтрино. Но это не более чем мысленный эксперимент, поставленный писателем. В реальной биологии нам приходится иметь дело только с атомами и их устойчивыми сочетаниями, которые называются молекулами. А из молекул, в свою очередь, складываются вещества. Как писал тот же Фейнман, любое вещество – это свой тип расположения атомов.
Мир атомов довольно разнообразен. На момент написания этих строк ученым известно 118 видов атомов, которые принято называть химическими элементами. Правда, в живых телах встречаются далеко не все из них, а те, что встречается, распределены там очень неравномерно.
Хорошая новость заключается в том, что атомы часто бывают очень долговечными. В тех процессах, которые непосредственно изучает биология, они почти никогда не распадаются, не возникают заново и не превращаются друг в друга. Это не означает, что они не превращаются друг в друга вообще никогда: очень скоро мы увидим, что, если бы не было взаимных превращений атомов (точнее, их ядер), во Вселенной не смогла бы возникнуть жизнь. Однако для понимания того, как устроены живые тела, нам будет вполне достаточно учитывать взаимодействие готовых и неизменных атомов между собой.
Кратко про атомы
Итак, атомы.
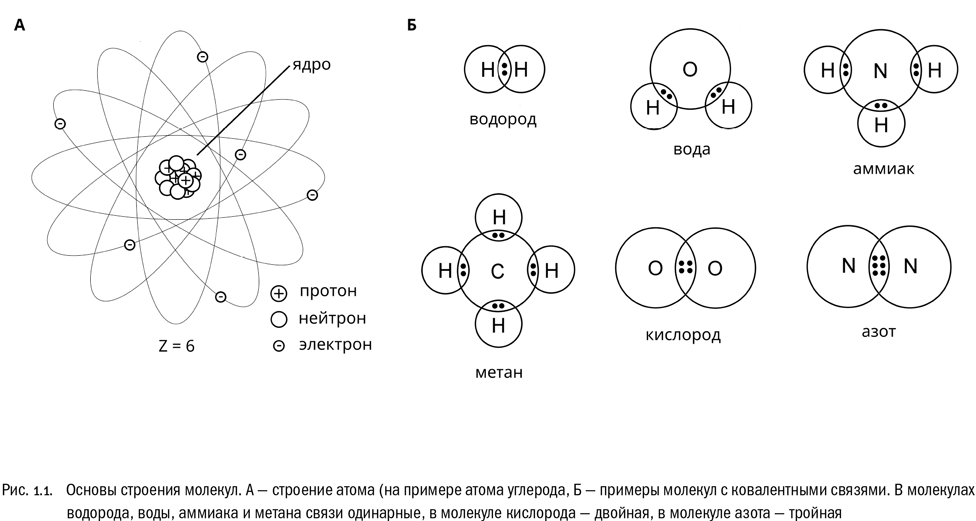
Уже довольно давно известно, что они состоят из трех типов элементарных частиц: протонов, нейтронов и электронов (см. рис. 1.1А). Протоны и нейтроны – частицы относительно массивные, любой из них примерно в 1800 раз тяжелее электрона. Из протонов и нейтронов состоит атомное ядро, а из электронов – внешняя оболочка атома, которую обычно прямо так и называют электронной оболочкой. Электроны, образующие оболочку, перемещаются вокруг ядра по чрезвычайно сложным траекториям, но, как правило, не слишком от него удаляясь.
Самое важное для нас свойство элементарных частиц даже не масса, а электрический заряд. Здесь действуют абсолютно четкие и очень простые закономерности.
• Протон электрически заряжен положительно, электрон – отрицательно, а нейтрон не имеет никакого заряда.
• По величине отрицательный заряд электрона строго равен положительному заряду протона. Принято считать, что протон имеет заряд +1, а электрон –1.
• Число электронов в атоме по умолчанию равно числу протонов, так что заряд целого атома равен нулю. Если же число электронов отличается от числа протонов, значит, перед нами не просто атом, а заряженная частица – ион.
Физики еще в XVIII веке выяснили, что электрические заряды бывают двух типов: положительные и отрицательные. Также они обнаружили, что разноименные заряды притягиваются, а одноименные отталкиваются. Этот закон называется основным законом электростатики, или законом Кулона (на самом деле он записывается формулой, позволяющей точно определить силу притяжения или отталкивания, но мы тут обойдемся без математики). Закон Кулона действует где угодно, в том числе и внутри атома. Собственно говоря, электроны и протоны потому и образуют единый атом, что они электростатически притягиваются друг к другу. Для справки добавим, что протоны и нейтроны “склеиваются” в атомное ядро притяжением совсем другого рода – так называемым сильным ядерным взаимодействием, которое на маленьких расстояниях гораздо мощнее электростатического. Именно поэтому протоны в ядре держатся вместе, несмотря на отталкивающую их друг от друга кулоновскую силу.
Самый главный параметр любого атома – это число протонов, или атомный номер (Z). Величина Z однозначно определяет положение данного атома в периодической системе элементов, то есть в таблице Менделеева. Как мы уже знаем, число электронов обычно равно числу протонов. А вот что касается числа нейтронов, то оно может при одном и том же числе протонов быть разным. Атомы, имеющие одинаковый атомный номер, но разное число нейтронов, называются изотопами. Если слово “изотопы” не упоминается, значит, число нейтронов нам в данном случае неважно. Все атомы, имеющие одинаковое число протонов, по определению относятся к одному химическому элементу.
Самый простой из всех возможных атомов – водород (Z=1). Он состоит из одного протона и одного электрона. Нейтронов в нем может не быть вовсе (хотя могут и быть, в зависимости от того, какой это изотоп). Если лишить обычный простейший атом водорода его единственного электрона, от него останется положительно заряженный ион, в данном случае представляющий собой не что иное, как “голый” протон.
Еще в начале XIX века английский химик и врач Уильям Праут выдвинул опередившую свое время гипотезу, что атомы всех других химических элементов образуются в результате объединения того или иного количества атомов водорода{6}. И он был не так уж далек от истины. Все атомы действительно состоят из однотипных частиц, самый простой возможный набор которых дает не что иное, как атом водорода (Z=1). Второй по сложности атом – гелий (Z=2), третий – литий (Z=3), ну а дальше в нашем распоряжении вся таблица Менделеева. Самые тяжелые атомы содержат больше сотни протонов и около двух сотен нейтронов. Но с такими чудовищами мы в биологии не встретимся.
Химические связи
Самый важный для нас способ взаимодействия атомов называется ковалентной связью (см. рис. 1.1Б). Это связь, образуемая общей парой электронов – по одному от каждого из двух атомов. Можно считать, что электроны этой пары принадлежат обоим атомам сразу. На графических формулах, отображающих строение молекул наглядно, ковалентную связь обозначают простой чертой между символами химических элементов. Именно такими связями и соединены атомы в большинстве обычных молекул. Пример – молекула водорода. Она состоит из двух атомов водорода (H), образующих единственную ковалентную связь между собой: H – H, или сокращенно H2.
Иногда ковалентные связи бывают двойными – образованными сразу двумя парами электронов – или даже тройными – образованными сразу тремя парами. Чем выше кратность связи, тем эта связь при прочих равных условиях прочнее. Двойные ковалентные связи встречаются в биологии очень часто. Тройные – намного реже, но знать об их существовании все-таки не помешает. На графических формулах двойные и тройные связи обозначают, соответственно, двойными или тройными черточками между символами атомов. Например, между атомами кислорода (O) вполне может образоваться двойная связь. В результате получится молекула O=O, или сокращенно O2. Кстати, это и есть тот самый атмосферный кислород, которым мы дышим.
Гораздо реже ковалентной (по крайней мере, в живой материи) встречается ионная связь, представляющая собой электростатическое притяжение заряженных частиц. Мы уже знаем, что по закону Кулона одноименные электрические заряды отталкиваются, а разноименные – притягиваются. Поэтому положительно заряженная частица (катион) и отрицательно заряженная (анион) обязательно притянутся друг к другу. Уже упоминалось, что ионом называется любая самостоятельно существующая частица, в которой число электронов отличается от числа протонов. Сам этот термин, предложенный Майклом Фарадеем, происходит от греческого слова, означающего “идущий”: в растворе, через который пропущен электрический ток, положительно заряженные ионы движутся к отрицательному полюсу, а отрицательные – к положительному Атом становится ионом, если он приобрел лишний электрон или, наоборот, часть своих электронов где-то потерял.
Отличный пример ионной связи демонстрирует всем известная поваренная соль NaCl (натрий хлор), формулу которой можно переписать как [Na+][Cl–]. Это означает, что кристалл соли состоит из положительно заряженных ионов натрия и отрицательно заряженных ионов хлора в соотношении один к одному. В данном случае каждый атом хлора как бы отбирает один электрон у соседнего атома натрия.


