
Татьяна Александровна Лобаева
Рабочая тетрадь-тренажер по биохимии
Утверждено Методическим советом по специальностям и направлениям медицинского института РУДН
Рецензенты:
Радыш Иван Васильевич – д.м.н., проф., зав. кафедрой управления сестринской деятельностью МИ РУДН
Смирнова Ксения Валерьевна – к.б.н., зав. лабораторией вирусного канцерогенеза НИИ канцерогенеза ФГБУ "НМИЦ онкологии им. Н. Н. Блохина" Минздрава России, доцент кафедры биохимии и молекулярной биологии РНИМУ им. Н. И. Пирогова
Предисловие к изданию
В настоящее время науки о жизни (англ. life sciences) включены в список приоритетных направлений развития науки и технологий до 2030 года. Одним из важнейших направлений life sciences является биохимия.
Биохимия – это фундаментальная наука, которая изучает состав, структуру и свойства химических соединений, формирующих биосистемы, а также их взаимодействие и взаимопревращение в процессе метаболизма. Это важнейшее естественно-научное направление, которое формирует мировоззрение современных биологов и медиков. Изучение биохимии базируется на важнейших представлениях о химии, биологии, физике.
Представленная автором книга, является продолжением серии учебно-методических пособий и учебников по биохимии, которые активно используются в учебно-методическом комплексе (УМК) при изучении данной дисциплины студентами-медиками в МИ РУДН.
Пособие «Рабочая тетрадь-тренажер по биохимии» составлено на основе программы и УМК, используемых на кафедре биохимии им. академика Берёзова Т. Т. в соответствии с ФГОС высшего образования и рассчитано для использования в учебном процессе ВУЗов по направлению подготовки 34.03.01 Сестринское дело (бакалавриат).
Сборник включает материалы по 12 темам биохимии, сгруппированных в 3 крупных раздела в соответсвии с порядком изучения материала и аттестации студентов:
• Введение в биохимию
• Аминокислоты и простые белки
• Нуклеозиды и нуклеотиды. Нуклеиновые кислоты. Матричные биосинтезы.
• Сложные белки
• Ферменты
• Липиды
• Витамины и коферменты
• Гормоны
• Основы метаболизма. Биоэнергетика. Химия и обмен углеводов.
• Обмен липидов
• Обмен аминокислот и простых белков
• Обмен сложных белков
Наполнение пособия составляют разноплановые учебно-методических материалы:
• Основные теоретические сведения курса «Основы биохимии»
• Основные термины и формулы биоорганических соединений и их метаболитов
• Вопросы для самоконтроля
• Упражнения и задачи
• Тесты
• Итоговые задания для самостоятельной работы
Пособие адресовано студентам, аспирантам, стажерам и преподавателям для использования в учебном процессе при проведении аудиторных занятий, организации самостоятельной работы студентов, а также для аттестации по биохимии.
Автор
Лобаева Татьяна Александровна – кандидат биологических наук, доцент по специальности «биохимия», доцент кафедры биохимии им. акад. Берёзова Т. Т. МИ РУДН, директор направления 06.06.01 Биологические науки (подготовка кадров высшей квалификации) в РУДН.
Требования к освоению дисциплины «Биохимия»
В результате изучения дисциплины студенты должны знать:
• правила техники безопасности и работы в биохимических лабораториях с реактивами, приборами, животными;
• физико-химическую сущность процессов, происходящих в живом организме на молекулярном, клеточном, тканевом и органном уровнях;
• строение и химические свойства основных классов биологически важных органических соединений;
• основные метаболические пути превращения углеводов, липидов, аминокислот, пуриновых и пиримидиновых оснований, роль клеточных мембран и их транспортных систем в обмене веществ;
• строение и функции наиболее важных химических соединений (нуклеиновых кислот, природных белков, водорастворимых и жирорастворимых витаминов, гормонов и др.);
• физико-химические методы анализа в медицине (титриметрический, хроматографический, спектрофотометрический, фотоэлектроколориметрический);
• роль биогенных элементов и их соединений в живых организмах;
• основы химии гемоглобина, его участие в газообмене и поддержании кислотно-основного состояния;
• теоретические основы информатики в медицинских и биологических системах, использование информационных компьютерных систем.
В результате изучения дисциплины студенты должны уметь:
• пользоваться учебной, научной, научно-популярной литературой, сетью Интернет и учебным порталом для профессиональной деятельности;
• пользоваться физическим, химическим и биологическим оборудованием;
• производить расчёты по результатам эксперимента, проводить элементарную статистическую обработку экспериментальных данных;
• классифицировать химические соединения, основываясь на их структурных формулах;
• прогнозировать направление и результат физико-химических процессов и химических превращений биологически важных веществ;
• отличать в сыворотке крови нормальные значения уровней метаболитов (глюкозы, мочевины, билирубина, мочевой кислоты, молочной и пировиноградной кислот и др.) от патологически изменённых, читать протеинограмму и объяснять причины различий; трактовать данные энзимодиагностических исследований сыворотки крови.
По окончании курса «Биохимия» студенты должны владеть:
• химической и биохимической терминологией;
• базовыми технологиями поиска и преобразования информации, в том числе с использованием учебных образовательных ресурсов;
• понятием ограничения в достоверности и специфику наиболее часто встречающихся лабораторных тестов
Список сокращений и условных обозначений, принятых в биохимии
АДФ – аденозиндифосфат
АлАТ – аланинаминотрансфераза
АМК – аминокислота
АМФ – аденозинмонофосфат
цАМФ – циклический АМФ
АПБ – ацилпереносящий белок
АсАТ – аспартатаминотрансфераза
АТФ – аденозинтрифосфат
АТФаза – аденозинтрифосфатаза
ГАМК – гамма-аминомасляная кислота
ГАФ – глицеральдегид-3-фосфат
ГДФ – гуанозиндифосфат
ГМФ – гуанозинмонофосфат
ГМГ-КоА —β-гидрокси-β-метил-глутарил-КоА
цГМФ – циклический ГМФ
ГТФ – гуанозинтрифосфат
ДАГ – диацилглицеролы
ДАФ – диоксиацетонфосфат
ДНК – дезоксирибонуклеиновая кислота
ДНКаза – дезоксирибонуклеаза
ДНФГ- 2,4-динитрофенилгидразин
ДОФА – диоксифенилаланин
ИМФ – инозинмонофосфат
кат – катал
КоА – кофермент (коэнзим) А
КоQ – кофермент (коэнзим) Q
КФ – классификация ферментов
КФК – креатинфосфокиназа
ЛДГ – лактатдегидрогеназа
ЛП – липопротеины
ЛПВП – липопротеины высокой плотности
ЛПНП – липопротеины низкой плотности
ЛПОНП – липопротеины очень низкой плотности
МАГ – моноацилглицеролы
МАО – моноаминооксидаза
МДА – малоновый диальдегид
НАД+ – никотинамидадениндинуклеотид окисленный
НАДН(Н+) – никотинамидадениндинуклеотид восстановленный
НАДФ+ – никотинамидадениндинуклеотидфосфат окисленный
НАДФН(Н+) – никотинамидадениндинуклеотидфосфат восстановленный
ПВК – пировиноградная кислота
ПФ – пиридоксальфосфат
РНК – рибонуклеиновая кислота
т-РНК – транспортная РНК
РНКаза – рибонуклеаза
СДГ – сукцинатдегидрогеназа
ТАГ – триацилглицеролы
ТГФК – тетрагидрофолиевая кислота
ТДФ – тимидиндифосфат
ТМФ – тимидинмонофосфат
ТПФ – тиаминпирофосфат
ТТФ – тимидинтрифосфат
ТХУ – трихлоруксусная кислота
УДФ – уридиндифосфат
УМФ – уридинмонофосфат
УТФ – уридинтрифосфат
ФАД – флавинадениндинуклеотид окисленный
ФАДН2 – флавинадениндинуклеотид восстановленный
ФЕП – фосфоенолпируват
ФМН – флавинаденинмононуклеотид
Фн – неорганический фосфат
ФФн – неорганический пирофосфат
ФРПФ – 5-фосфорибозил-1-пирофосфат
ФФК – фосфофруктокиназа
ФЭК – фотоэлектроколориметр
ХЭ – холинэстераза
ЦДФ – цитидиндифосфат
ЦМФ – цитидинмонофосфат
ЦТК – цикл трикарбоновых кислот (цикл Кребса)
ЦТФ – цитидинтрифосфат
ЩУК – щавелевоуксусная кислота
ЭПС – эндоплазматическая сеть
D – оптическая плотность
Dоп – оптическая плотность опытного образца
Dст – оптическая плотность стандартного образца
Dк – оптическая плотность контрольного образца
Dx – оптическая плотность исследуемого образца
КМ – константа Михаэлиса
Vmax – максимальная скорость реакции
SAM – S-аденозилметионин
Введение в биохимию
Биохимия – это фундаментальная наука, которая изучает состав, строение и свойства веществ, входящих в состав биологических систем, а также их превращения в процессе жизнедеятельности.
Главной задачей биохимии является установление связи между молекулярной структурой и биологической функцией химических компонентов организма.
Таблица 1.
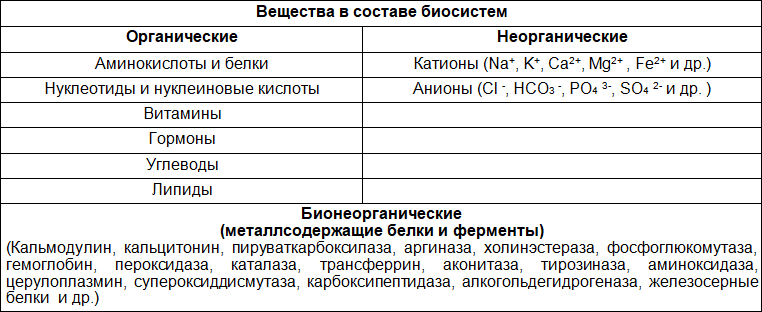
Для поэтапного изучения биохимии рекомендуется следовать логике данного пособия и выполнять задания от более простых к более сложным. Поэтому начнем изучение материала с повторения общей, органической и биоорганической химии.
Функциональные группы в структуре органических молекул:

ЧТО НЕОБХОДИМО ЗНАТЬ В ДАННОЙ ТЕМЕ?
Функциональные группы: карбоксильная, альдегидная, кетогруппа, аминогруппа, сульфгидрильная, гидроксильная, амидная, гуанидиновая, фосфатный остаток (фосфаты), сульфатный остаток (сульфаты)
Радикалы: метил-, этил-, пропил-, изопропил-, бутил-, бензил-, фенил
Гетероциклы в структуре органических соединений: пиридин, пиримидин, пиррол, тиазол, имидазол, индол, пурин, птерин, изоаллоксазин
Типы ковалентных химических связей: простая эфирная, сложноэфирная, дисульфидная, амидная (пептидная), гликозидная, 3,5-фосфодиэфирная
Типы слабых химических взаимодействий и связей in vivo: водородная, ионная, гидрофобная
Основные типы химических реакций in vivo: фосфорилирование, сульфирование, метилирование, гидроксилирование, гидролиз, гидратация, карбоксилирование, декарбоксилирование, ОВР (редокс-процессы), ацилирование
Органические кислоты: дикарбоновые (с примерами), тракарбоновые (с примерами), кетокислоты, гидроксикислоты
Аминоспирты: этаноламин, холин, сфингозин
Многоатомные спирты: глицерин
Кетоны: ацетон
Альдегиды: уксусный альдегид
Сложные эфиры: ацилглицеролы, ацетилхолин
Простые эфиры: дисахариды, полисахариды
Биополимеры: белки, полисахариды, нуклеиновые кислоты
ЗАДАНИЕ 1
Дайте определения нижеследующим важнейшим понятиям из общей и биоорганической химии, приведите соответствующие примеры, заполнив таблицу:


ЗАДАНИЕ 2
Перечислите все известные вам кислородсодержащие функциональные группы в структуре органических соединений:
_____________________________________
_____________________________________
Допишите структурную формулу первичного насыщенного спирта с общим числом атомов углерода, равным 5. Назовите его по систематической номенклатуре.
– C–C – C–C – C – OH
Предположите физические, химические и биологические свойства этого соединения:
_____________________________________
_____________________________________
Составьте 1–2 формулы спиртов из предложенного списка и обведите в этих формулах спиртовой гидроксил: глицерол, ретинол, токоферол, холестерол, пиридоксин, андростендиол, эстрадиол, кальцитриол.

Составьте 1–2 формулы формулы альдегидов из предложенного списка и обведите в этих формулах альдегидную группу: ретиналь, пиридоксальфосфат,

Составьте 1–2 формулы кетонов из предложенного списка и обведите в этих формулах кетогруппы: ацетон, ацетоацетат, филлохинон, тестостерон, альдостерон, прогестерон.

Составьте 1–2 формулы органических кислот из предложенного списка и обведите в этих формулах карбоксильные группы: яблочная кислота, янтарная кислота, фумаровая кислота, стеариновая кислота, олеиновая кислота, никотиновая кислота, пантотеновая кислота.

ЗАДАНИЕ 3
Перечислите все известные вам азотсодержащие функциональные группы в структуре органических соединений.
Допишите структурную формулу первичного амина с общим числом атомов углерода, равным 3. Назовите его по систематической номенклатуре.
– C–C – C – NH2
Предположите физические, химические и биологические свойства этого соединения:
Составьте 1–2 формулы аминов из предложенного списка и обведите в этих формулах аминогруппы: этаноламин, холин, ацетилхолин, норадреналин, адреналин, пиридоксаминфосфат, гистамин, серотонин.

ЗАДАНИЕ 4
Перечислите все известные вам серосодержащие функциональные группы в структуре органических соединений.
Допишите структурную формулу органического соединения с одной сульфгидрильной группой с общим числом атомов углерода, равным 2. Назовите его по систематической номенклатуре.
– C–C – SH
Предположите физические, химические и биологические свойства этого соединения:
Составьте 1–2 формулы соединений с SH-группой из предложенного списка и обведите в этих формулах сульфгидрильную группу: цистеин, глутатион, коэнзим А.

ЗАДАНИЕ 5
Перечислите все известные вам фосфоросодержащие функциональные группы в структуре органических соединений.
Соедините аминокислоту серин с фосфорной кислотой, покажите образованную формулу фосфосерина.

Составьте схему строения АТФ, выделив остатки фосфорной кислоты.

Составьте 1–2 формулы соединений с остатком фосфорной кислоты из предложенного списка и обведите в этих формулах фосфатный фрагмент: 2-фосфоглицериновая кислота, 3-фосфоглицериновая кислота, глицеральдегид-3-фосфат, диоксиацетонфосфат, фосфоенолпируват.

ЗАДАНИЕ 6
Перечислите все известные вам пятичленные гетероциклы.
Составьте формулу пиррола. Предположите физико-химические и биологические свойства пиррол-содержащих биоорганических соединений.

Проанализируйте потенциальные физико-химические и биологические свойства соединения на основе его химической формулы:
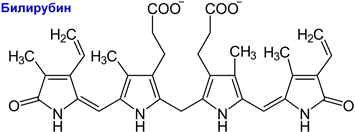
Перечислите все известные вам шестичленные гетероциклы.
Составьте формулу пиридина Предположите физико-химические и биологические свойства пиридинсодержащих биоорганических соединений.

Проанализируйте потенциальные физико-химические и биологические свойства двух родственных соединений на основе их химической структуры:

Раздел I. Аминокислоты и простые белки. Сложные белки. Нуклеотиды и нуклеиновые кислоты. Ферменты. Витамины. Гормоны
Теоретический блок. Основные теоретические сведения и термины раздела
Аминокислоты
Аминокислоты – это органические карбоновые кислоты, у которых, один атом водорода замещен на аминогруппу. Таким образом, аминокислоты содержат карбоксильную группу (-СООН), аминогруппу (-NH2), асимметричный атом углерода и боковую цепь (радикал – R). Именно строением боковой цепи аминокислоты и отличаются друг от друга.
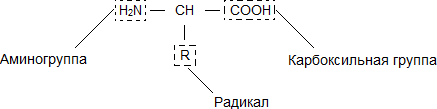
Рис. 1. Общий план строения аминокислот
Аминокислоты, кодируемые генетическим кодом и включающиеся в процессе трансляции в белки человека, называют протеиногенными. Таких аминокислот 20, часть из них может синтезироваться в организме человека (заменимые аминокислоты), а часть поступает с пищей (незаменимые аминокислоты).
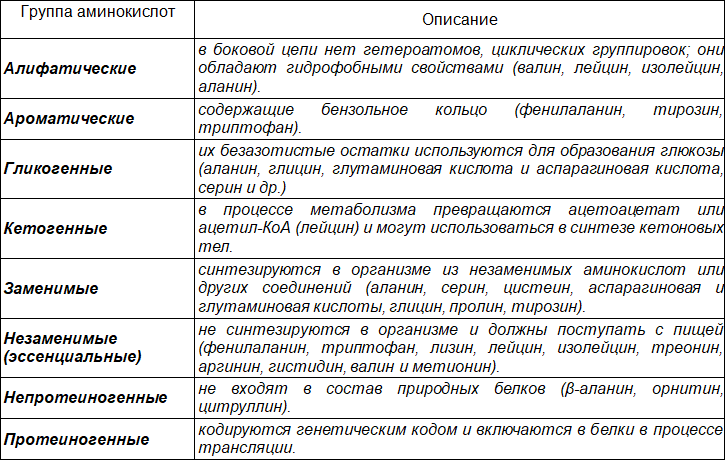
В основу современной классификации аминокислот положено химическое строение их радикалов. Согласно это классификации протеиногенные аминокислоты делятся на 3 группы: гидрофобные, гидрофильные (незаряженные, отрицательно и положительно заряженные) и амфифильные.
Каждая аминокислота имеет не только своё название (тривиальное и химическое), но и принятое трехбуквенное сокращение, а также латинский однобуквенный символ: Ala Аланин (A), Leu Лейцин (L), Arg Аргинин (R), Lys Лизин (K), Asn Аспарагин (N), Met Метионин (M), Asp Аспарагиновая кислота (D), Phe Фенилаланин (F), Cys Цистеин (C), Pro Пролин (P), Gln Глутамин (Q), Ser Серин (S), Glu Глутамин. к-та (E), Thr Треонин (T), Gly Глицин (G), Trp Триптофан (W), His Гистидин (H), Tyr Тирозин (Y), Ile Изолейцин (I), Val Валин (V).
Таблица 2. Описание аминокислот

Следует отметить, что аминокислоты являются не только структурными элементами пептидов и белков, но и входят в состав других природных соединений (коферментов, конъюгированных желчных кислот, антибиотиков). Некоторые аминокислоты являются предшественниками биологически активных веществ (гормонов, биогенных аминов) или важнейшими метаболитами (глюконеогенез, биосинтез и деградация протеиногенных аминокислот, цикл мочевинообразования).
Таблица 3. Подходы к классификации аминокислот
Белки и пептиды
Пептиды – это органические соединения, построенные из остатков аминокислот, соединенных с помощью пептидной связи. Пептиды, последовательность которых короче 10–20 аминокислотных остатков, могут также называться олигопептидами, при большей длине последовательности они называются полипептидами.
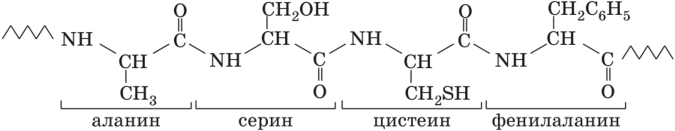
Рис. 2. Общий план строения пептида
Белками обычно называют полипептиды, содержащие 50 аминокислотных остатков и более.
Белки оставляют основу структурных элементов клеток и тканей, а также выполняют многообразные жизненно важные функции (транспортные, защитные, регуляторные, каталитические), обусловленные способностью за счет своей уникальной пространственной конфигурации распознавать другие молекулы и взаимодействовать с ними.
Полипептидная цепь состоит из остова (скелета), имеющего повторяющуюся последовательность и отдельных боковых цепей (радикалов). Последовательность аминокислот в цепи изображают, начиная с N-конца. Единственным отличием одних белков от других является сочетание радикалов, входящих в него.
Каждый белок характеризуется специфической аминокислотной последовательностью и индивидуальной пространственной структурой (конформацией).
Таблица 4. Уровни структурной организации белков

Белки условно подразделяют на простые (при гидролизе образуют смесь аминокислот) и сложные, или конъюгированные (состоят из белкового и небелкового компонентов). В качестве небелковой части (простетической группы) сложных белков могут выступать различные химические соединения, что находит отражение в классификации данной группы биологических соединений.
Таблица 5. Подходы к классификации сложных белков

Большинство методов анализа белков и аминокислот связаны с физико-химическими свойствами последних, например, с наличием определенных функциональных групп, размером и формой молекул, подвижностью в электрическом поле, различным распределением в системе подвижной и неподвижной фазы при разных видах хроматографии, способностью к поглощению в ультрафиолетовой области спектра.
Таблица 6. Методы очистки и анализа белков и аминокислот

Основные термины:
α-Аминокислоты – производные карбоновых (органических) кислот, у которых один из атомов водорода у α-углеродного атома замещен на аминогруппу
Белки – высокомолекулярные соединения, биополимеры, состоящие из остатков аминокислот, соединенных пептидными (амидными) связями, имеющие определённую структурную и пространственную организацию и обладающие различными функциями.
Изоэлектрическая точка (ИЭТ, pI) – значение pH среды, при котором суммарный заряд амфотерного соединения равен нулю
Полипептиды – биополимеры, содержащие от 10 до 50 аминокислотных остатков, связанных пептидными связями.
Посттрансляционная модификация – процесс образования функционально активных белков из синтезированных на рибосомах полипептидных цепей с использованием механизма частичного протеолиза (тримминга) и химической модификации аминокислотных радикалов (гидроксилирование, карбоксилирование, фосфорилирование, окисление и др.)
Фолдинг – процесс формирования третичной (трехмерной) пространственной структуры белка из полипептидной цепи при участии специфических белков-шаперонов.
Шапероны – группа белков, обеспечивающих правильную пространственную укладку полипептидной цепи в процессе посттрансляционной модификации, а также ренатурацию поврежденных белков и стабилизацию белков с неустойчивой конформацией
Нуклеотиды и нуклеиновые кислоты
Нуклеиновые кислоты – это биополимеры, мономерами которых являются нуклеотиды. Любой нуклеотид в своей структуре имеет 3 фрагмента:
1) пуриновое или пиримидиновое азотистое основание;
2) остаток сахара-пентозы (рибозы или дезоксирибозы);
3) остаток фосфорной кислоты.
В зависимости от числа фосфатных групп различают нуклеозидмонофосфаты (например, АМФ, ГМФ), нуклеозиддифосфаты (УДФ, ЦДФ) и нуклеозидтрифосфаты (АТФ, УТФ); название нуклеотидов формируется в зависимости от азотистого основания и числа остатков фосфорной кислоты.
Нуклеиновые кислоты выполняют функцию хранения и передачи наследственной информации, а их структурные компоненты (нуклеотиды) входят в состав коферментов (НАД+, ФАД, КоА), являются макроэргическими соединениями (АТФ, УТФ, ЦТФ, ГТФ, ТТФ) и вторичными посредниками в передаче гормонального сигнала (цАМФ, цГМФ).
Гетероциклы, лежащие в основе структуры азотистых оснований:

К пуриновым азотистым основаниям относят аденин (6-аминопурин) и гуанин (2-амино-6-гидроксипурин).

К пиримидиновым азотистым основаниям относят урацил (2,4-дигидроксипиримидин), тимин (5-метилурацил; 2,4-дигидрокси-5-метилпиримидин), цитозин (4-амино-2-гидроксипиримидин).

Различают также минорные азотистые основания, которые представляют собой видоизмененные азотистые основания, отличающиеся по строению от аденина, гуанина, урацила и тимина; к ним относятся 5-оксиметилцитозин, дигидроурацил, псевдоурацил, 1-метилурацил, оротовая кислота, N6-метиладенин, N-метилгуанин, и др.
Основные термины:
Азотистые основания – общее название азотсодержащих гетероциклических органических соединений, входящих в состав нуклеозидов и нуклеотидов
Нуклеозиды – органические природные соединения, состоящие из пиримидинового или пуринового основания, связанного N-гликозидной связью с остатком сахара пентозы
Нуклеотиды – природные или синтетические соединения, у которых гидроксильный остаток пентозы в составе нуклеозида этерифицирован одной или несколькими фосфатными группами
Нуклеиновые кислоты – природные органические соединения – биополимеры, мономерами которых являются мононуклеотиды, связанные 3,5 -фосфодиэфирной связью







